题目内容
17.反应CH3OH(g)+NH3(g)═CH3NH2(g)+H2O(g)在高温下才能自发向右进行,则该反应的△H、△S应为( )| A. | △H>0、△S<0 | B. | △H<0、△S>0 | C. | △H>0、△S>0 | D. | △H<0、△S<0 |
分析 在等温、等压条件下,化学反应的方向是由反应的焓变和熵变共同决定的.化学反应自发进行的最终判据是吉布斯自由能变,自由能一般用△G来表示.且△G=△H-T△S:当△G=△H-T△S<0时,反应向正反应方向能自发进行,据此判断.
解答 解:反应CH3OH(g)+NH3(g)═CH3NH2(g)+H2O(g)在高温下才能自发向右进行,则满足△H-T△S<0,
A.△H>0、△S<0,△H-T△S>0,反应不能自发进行,故A 错误;
B.△H<0、△S>0,要保证△H-T△S<0,则T为低温,故B错误;
C.△H>0、△S>0,要保证△H-T△S<0,则T为高温,故C正确;
D.△H<0、△S<0,△H-T△S<0一定成立,反应在任何温度下一定能够自发进行,故D错误;
故选:C.
点评 本题考查了反应自发进行方向的判断,明确化学反应的方向是由反应的焓变和熵变共同决定的,当△G=△H-T△S<0时,反应向正反应方向能自发进行是解题关键,题目难度不大.

练习册系列答案
相关题目
5.下列各组元素的性质递变情况错误的是( )
| A. | Li、Be、B原子最外层电子数依次增多 | |
| B. | P、S、Cl元素最高正价依次升高 | |
| C. | N、O、F原子半径依次增大 | |
| D. | Li、Na、K、Rb单质的密度依次增大 |
12.下列说法正确的是( )
| A. | 化学反应除了生成新的物质外,还伴随着能量的变化 | |
| B. | 吸热反应不加热就不会发生 | |
| C. | 放热的化学反应不需要加热就能发生 | |
| D. | 据能量守恒定律,反应物的总能量一定等于生成物的总能量 |
7.将元素周期表原先的主、副族族号取消,从左往右改为18列,碱金属为第1列,稀有气体为第18列,按这个规定,下列说法不正确的是( )
| A. | 不仅有第2列元素的原子最外层有2个电子 | |
| B. | 第3~12列元素全为金属 | |
| C. | 第3列元素种类最多 | |
| D. | 第15、16、17列元素都是非金属元素 |
 ,加聚反应.
,加聚反应. +3HNO3(浓)$→_{△}^{浓硫酸}$
+3HNO3(浓)$→_{△}^{浓硫酸}$ +3H2O,取代反应.
+3H2O,取代反应.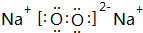
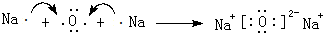 .
.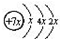 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题: ,这样排布遵循了构造原理、泡利原理和洪特规则.
,这样排布遵循了构造原理、泡利原理和洪特规则.