题目内容
11.在25℃时,pH等于11的NaOH溶液和NaCN溶液中,水的电离度大小的比较正确的是( )| A. | 两者相等 | B. | 前者比后者大11倍 | ||
| C. | 后者是前者的108倍 | D. | 后者是前者的1011倍 |
分析 酸或碱抑制水电离,含有弱离子的盐促进水电离,NaOH是强碱、NaCN是强碱弱酸盐,所以NaOH抑制水电离、NaCN促进水电离,前者水电离出c(OH-)=c(H+)=10-11 mol/L,后者水电离出c(OH-)=$\frac{{K}_{w}}{c({H}^{+})}$,据此分析解答.
解答 解:A.酸或碱抑制水电离,含有弱离子的盐促进水电离,NaOH是强碱、NaCN是强碱弱酸盐,所以NaOH抑制水电离、NaCN促进水电离,所以前者水电离程度小于后者;
前者水电离出c(OH-)=c(H+)=10-11 mol/L,后者水电离出c(OH-)=$\frac{{K}_{w}}{c({H}^{+})}$=$\frac{1{0}^{-14}}{1{0}^{-11}}$mol/L=10-3mol/L,所以后者水电离程度是前者的108倍,故选C.
点评 本题考查盐类水解及水的电离,为高频考点,侧重考查学生分析计算能力,明确影响水电离因素是解本题关键,难点是计算碱溶液中水电离出的c(OH-),题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
15.下列叙述中指定粒子数目一定大于NA的是( )
| A. | 1L1mol/LCH3COOH溶液中所含分子总数 | |
| B. | 1molCl2参加化学反应获得的电子数 | |
| C. | 常温常压下,11.2LN2和NO的混合气体所含的原子数 | |
| D. | 28g铁在反应中作还原剂时,失去电子的数目 |
16.常温下,下列各组离子一定能在指定溶液中大量共存的是( )
| A. | 是酚酞变红色的溶液:K+、Fe3+、SO42-、Cl- | |
| B. | 水电离的c(H+)=1×10-13mol/L的溶液中:K+、Na+、AlO2-、CO32- | |
| C. | 与Al反应能放出H2的溶液中:Fe2+、Na+、NO3-、SO42- | |
| D. | $\frac{{K}_{W}}{c({H}^{+})}$=1×10-13mol/L的溶液中:NH4+、Cu2+、Cl-、NO3- |
6.t℃时,AgCl 的 Ksp=2×10-10;Ag2CrO4是一种橙红色固体,在水中的沉淀溶解平衡曲 线如图所示.下列说法正确的是( )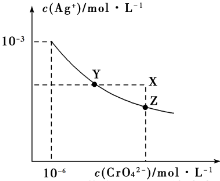

| A. | 在 t℃时,AgCl 的溶解度大于 Ag2CrO4 | |
| B. | 在 t℃时,Ag2CrO4的 Ksp=1×10-1210-3 | |
| C. | 在饱和 Ag2CrO4溶液中加入K2CrO4,可使溶液由Y点到X 点 | |
| D. | 在 t℃时,用 AgNO3 标准溶液滴定 20mL 未知浓度的 KCl 溶液,不能采用K2CrO4溶液为指示剂 |
16.准确移取20.00mL某待测HCl溶液于锥形瓶中,用0.1000mol•L-1NaOH溶液滴定,测HCl溶液的浓度,下列操作中正确的是( )
| A. | 锥形瓶用蒸馏水洗涤后,用待测HCl溶液润洗 | |
| B. | 滴定管用蒸馏水洗涤后,直接装入NaOH溶液进行滴定 | |
| C. | 滴定时,没有逐出滴定管下口的气泡 | |
| D. | 读数时,视线与滴定管内液体的凹液面最低处保持相平 |
3.某实验小组用如图所示装置制备一硝基甲苯(包括对硝基甲苯和邻硝基甲苯)

反应原理:

实验步骤:①浓硫酸与浓硝酸按体积比1:3配制混合溶液(即混酸)共40mL;
②在三颈瓶中加入13g甲苯(易挥发),按图所示装好药品和其他仪器;
③向三颈瓶中加入混酸;
④控制温度约为50℃-55℃,反应大约10min,三颈瓶底有大量淡黄色油状液体出现;
⑤分离出一硝基甲苯,经提纯最终得到对硝基甲苯和邻硝基甲苯共15g.
相关物质的性质如下:
(1)仪器A的名称是分液漏斗.
(2)配制混酸的方法是量取30mL浓硝酸倒入烧杯中,再量取10mL浓硫酸沿烧杯内壁(或玻璃棒)缓缓注入烧杯并不断搅拌.
(3)若实验后在三颈瓶中收集的产物较少,可能的原因是:混酸未冷却加入三颈瓶(或水浴温度过高)导致反应温度过高而产生大量副产物或冷凝效果不佳导致浓硝酸、甲苯等反应物挥发而降低一硝基甲苯产率.
(4)本实验采用水浴加热,水浴加热的优点是受热均匀、易于控制温度.
(5)分离反应后产物的方案如下:
混合液$\stackrel{操作1}{→}$$\left\{\begin{array}{l}{有机混合物\stackrel{操作2}{→}\left\{\begin{array}{l}{甲苯}\\{邻对硝基甲苯}\end{array}\right.}\\{无机混合物}\end{array}\right.$
操作1的名称是分液,操作2中不需要用到下列仪器中的de.(填序号)
a.冷凝管
b.酒精灯
c.温度计
d.分液漏斗
e.蒸发皿
(6)本实验中邻、对硝基甲苯的产率为77.5%(结果保留小数点后一位数字).

反应原理:

实验步骤:①浓硫酸与浓硝酸按体积比1:3配制混合溶液(即混酸)共40mL;
②在三颈瓶中加入13g甲苯(易挥发),按图所示装好药品和其他仪器;
③向三颈瓶中加入混酸;
④控制温度约为50℃-55℃,反应大约10min,三颈瓶底有大量淡黄色油状液体出现;
⑤分离出一硝基甲苯,经提纯最终得到对硝基甲苯和邻硝基甲苯共15g.
相关物质的性质如下:
| 密度/g•cm-3 | 沸点/℃ | 溶解性 | |
| 甲苯 | 0.866 | 110.6 | 不溶于水 |
| 对硝基甲苯 | 1.286 | 237.7 | 不溶于水,易溶于液态烃 |
| 邻硝基甲苯 | 1.162 | 222 | 不溶于水,易溶于液态烃 |
(2)配制混酸的方法是量取30mL浓硝酸倒入烧杯中,再量取10mL浓硫酸沿烧杯内壁(或玻璃棒)缓缓注入烧杯并不断搅拌.
(3)若实验后在三颈瓶中收集的产物较少,可能的原因是:混酸未冷却加入三颈瓶(或水浴温度过高)导致反应温度过高而产生大量副产物或冷凝效果不佳导致浓硝酸、甲苯等反应物挥发而降低一硝基甲苯产率.
(4)本实验采用水浴加热,水浴加热的优点是受热均匀、易于控制温度.
(5)分离反应后产物的方案如下:
混合液$\stackrel{操作1}{→}$$\left\{\begin{array}{l}{有机混合物\stackrel{操作2}{→}\left\{\begin{array}{l}{甲苯}\\{邻对硝基甲苯}\end{array}\right.}\\{无机混合物}\end{array}\right.$
操作1的名称是分液,操作2中不需要用到下列仪器中的de.(填序号)
a.冷凝管
b.酒精灯
c.温度计
d.分液漏斗
e.蒸发皿
(6)本实验中邻、对硝基甲苯的产率为77.5%(结果保留小数点后一位数字).
20.下列陈述I、II正确并且有因果关系的是( )
| 选项 | 陈述I | 陈述II |
| A | 酸性:HCl>H2CO3 | 非金属性:Cl>C |
| B | K+、Ca2+、Mg2+ 的离子半径依次减小 | K+、Ca2+、Mg2+氧化性性依次增强 |
| C | 硬铝是合金 | 其熔点比金属铝的熔点低 |
| D | 电镀时阳极上发生还原反应 | 可在铁的镀件上镀铜 |
| A. | A | B. | B | C. | C | D. | D |
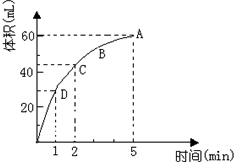 加入0.1mol的MnO2粉末于50mL过氧化氢的溶液中(密度为 1.1g/mL),在标准状况下放出气体的体积和时间的关系如图所示(假设溶液体积不变),回答下列问题:
加入0.1mol的MnO2粉末于50mL过氧化氢的溶液中(密度为 1.1g/mL),在标准状况下放出气体的体积和时间的关系如图所示(假设溶液体积不变),回答下列问题: