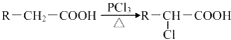题目内容
15.下列叙述中指定粒子数目一定大于NA的是( )| A. | 1L1mol/LCH3COOH溶液中所含分子总数 | |
| B. | 1molCl2参加化学反应获得的电子数 | |
| C. | 常温常压下,11.2LN2和NO的混合气体所含的原子数 | |
| D. | 28g铁在反应中作还原剂时,失去电子的数目 |
分析 A.醋酸为弱电解质,部分电离,醋酸溶液中含有大量的水分子;
B.氯气与铁反应生成氯化铁,与水反应生成氯化氢和次氯酸;
C.常温常压Vm>22.4L/mol;
D.铁做还原剂,氧化产物可能为二价铁或者三价铁离子.
解答 解:A.1L1mol/LCH3COOH溶液中含有醋酸分子和大量的水分子,所含分子总数大于NA,故A正确;
B.氯气与铁反应生成氯化铁,与水反应生成氯化氢和次氯酸,两种情况下,1molCl2参加反应转移电子数转移电子数可能等于1NA或者2NA,故B错误;
C.常温常压Vm>22.4L/mol,则11.2LN2和NO的混合气体所含的分子数小于0.5mol,含有的原子数小于0.5mol×2=1mol,故C错误;
D.铁做还原剂,氧化产物可能为二价铁或者三价铁离子,所以28g铁在反应中作还原剂时,失去电子的数目可能为1NA或者1.5NA,故D错误;
故选:A.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确标况下气体摩尔体积的使用条件,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系是解题关键,注意铁、氯气在反应中表现的性质.

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案
相关题目
5.设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温常压下,11.2 L CO和CO2混合气体中含有的碳原子数目为0.5NA | |
| B. | 标准状况下,7.1 g氯气与足量氢氧化钠溶液反应转移的电子数为0.2NA | |
| C. | 常温常压下,4.6 g乙醇中含有的极性共价键数目为0.8NA | |
| D. | 在1 L 1.0 mol•L-1碳酸钠溶液中,阴离子总数大于NA |
6.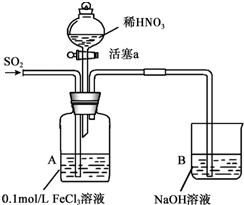 某化学小组探究酸性条件下NO3-、SO42-、Fe3+三种微粒的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).(忽略氧气对反应的影响)
某化学小组探究酸性条件下NO3-、SO42-、Fe3+三种微粒的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).(忽略氧气对反应的影响)
实验记录如下:
请回答下列问题:
(1)配制FeCl3溶液时,常常加入盐酸,目的是(用化学用语和简单文字叙述):铁离子水解:Fe3++3H2O Fe(OH)3+3H+,加入盐酸,增大c(H+),平衡左移,抑制Fe3+水解.
Fe(OH)3+3H+,加入盐酸,增大c(H+),平衡左移,抑制Fe3+水解.
(2)资料表明,Fe3+能与SO2结合形成深红棕色物质Fe(SO2)63+,反应方程式为:Fe3++6SO2?Fe(SO2)63+.请用化学平衡移动原理解释实验I中溶液颜色变化的原因Fe3+和SO2生成红棕色的Fe(SO2)63+反应速率较快:Fe3++6SO2 Fe(SO2)63+;而反应2Fe3++SO2+2H2O=2Fe2++SO42-+4H+反应缓慢,但是反应限度较大,使溶液中c(Fe3+)降低,平衡逆向移动,红棕色逐渐褪去,最终得到浅绿色溶液.
Fe(SO2)63+;而反应2Fe3++SO2+2H2O=2Fe2++SO42-+4H+反应缓慢,但是反应限度较大,使溶液中c(Fe3+)降低,平衡逆向移动,红棕色逐渐褪去,最终得到浅绿色溶液.
(3)实验II中发生反应的离子方程式是Ba2++SO42-=BaSO4↓.
(4)实验III中,浅绿色溶液变为黄色的原因是3Fe2++4H++NO3-=3Fe3++NO↑+2H2O.
(5)实验IV中液面上方有少量红棕色气体生成,发生反应的方程式是2NO+O2=2NO2.
(6)综合上述实验得出的结论是:在酸性条件下,氧化性强弱是:NO3->Fe3+>SO42-.请从微粒变化的角度解释实验II中溶液中检出Fe2+和SO42-,说明Fe3+氧化SO2生成SO42-,氧化性Fe3+>SO42-;实验III中溶液变黄色、IV中检出Fe3+和NO生成,说明酸性条件下NO3-氧化Fe2+,氧化性NO3->Fe3+;所以,在酸性条件下,氧化性强弱是:NO3->Fe3+>SO42-.
 某化学小组探究酸性条件下NO3-、SO42-、Fe3+三种微粒的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).(忽略氧气对反应的影响)
某化学小组探究酸性条件下NO3-、SO42-、Fe3+三种微粒的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).(忽略氧气对反应的影响)实验记录如下:
| 实验序号 | 实验操作 | 实验现象 |
| I | 向A装置中通入一段时间的SO2气体. | A中黄色溶液迅速变成深红棕色,最终变为浅绿色. |
| II | 取出少量A装置中的溶液,先加入KSCN溶液,再加入BaCl2溶液. | 加入KSCN溶液后溶液不变色,再加入BaCl2溶液产生白色沉淀. |
| III | 打开活塞a,将过量稀HNO3加入装置A中,关闭活塞a. | A中浅绿色溶液最终变为黄色. |
| IV | 取出少量A装置中的溶液,加入KSCN溶液;向A装置中注入空气. | 溶液变为红色;液面上方有少量红棕色气体生成. |
(1)配制FeCl3溶液时,常常加入盐酸,目的是(用化学用语和简单文字叙述):铁离子水解:Fe3++3H2O
 Fe(OH)3+3H+,加入盐酸,增大c(H+),平衡左移,抑制Fe3+水解.
Fe(OH)3+3H+,加入盐酸,增大c(H+),平衡左移,抑制Fe3+水解.(2)资料表明,Fe3+能与SO2结合形成深红棕色物质Fe(SO2)63+,反应方程式为:Fe3++6SO2?Fe(SO2)63+.请用化学平衡移动原理解释实验I中溶液颜色变化的原因Fe3+和SO2生成红棕色的Fe(SO2)63+反应速率较快:Fe3++6SO2
 Fe(SO2)63+;而反应2Fe3++SO2+2H2O=2Fe2++SO42-+4H+反应缓慢,但是反应限度较大,使溶液中c(Fe3+)降低,平衡逆向移动,红棕色逐渐褪去,最终得到浅绿色溶液.
Fe(SO2)63+;而反应2Fe3++SO2+2H2O=2Fe2++SO42-+4H+反应缓慢,但是反应限度较大,使溶液中c(Fe3+)降低,平衡逆向移动,红棕色逐渐褪去,最终得到浅绿色溶液.(3)实验II中发生反应的离子方程式是Ba2++SO42-=BaSO4↓.
(4)实验III中,浅绿色溶液变为黄色的原因是3Fe2++4H++NO3-=3Fe3++NO↑+2H2O.
(5)实验IV中液面上方有少量红棕色气体生成,发生反应的方程式是2NO+O2=2NO2.
(6)综合上述实验得出的结论是:在酸性条件下,氧化性强弱是:NO3->Fe3+>SO42-.请从微粒变化的角度解释实验II中溶液中检出Fe2+和SO42-,说明Fe3+氧化SO2生成SO42-,氧化性Fe3+>SO42-;实验III中溶液变黄色、IV中检出Fe3+和NO生成,说明酸性条件下NO3-氧化Fe2+,氧化性NO3->Fe3+;所以,在酸性条件下,氧化性强弱是:NO3->Fe3+>SO42-.
3.关于阿司匹林,下列说法正确的是( )


| A. | 不能用FeCl3 溶液鉴别水杨酸和阿司匹林 | |
| B. | 服用阿司匹林出现水杨酸反应时,可静脉注射NaHCO3溶液 | |
| C. | 1 mol阿司匹林最多可消耗2 mol NaOH | |
| D. | 该反应不属于取代反应 |
10.下列有关物质性质和应用的因果关系正确的是( )
| A. | 二氧化硫具有漂白性,能使氯水褪色 | |
| B. | 浓硫酸具有较强酸性,能使Cu转化为Cu2+ | |
| C. | 硅具有还原性,一定条件下能将铁从其氧化物中置换出来 | |
| D. | 二氧化锰具有强氧化性,能将双氧水氧化为氧气 |
7.下列过程中颜色变化叙述正确的是( )
| A. | 湿润淀粉碘化钾试纸遇NO2变蓝 | B. | 溴化银见光分解变白 | ||
| C. | 热的氧化铜遇乙醇变绿 | D. | 苯酚遇石蕊试液变红 |
4.用NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,33.6LHF中含有氟原子的数目为1.5NA | |
| B. | 12g石墨和C60的混合物中质子总数为6NA | |
| C. | 在0.1mol•L-1的碳酸钠溶液中,阴离子总数一定大于0.lNA | |
| D. | 标准状况下,0.1mol己烷中共价键数目为19NA |
11.在25℃时,pH等于11的NaOH溶液和NaCN溶液中,水的电离度大小的比较正确的是( )
| A. | 两者相等 | B. | 前者比后者大11倍 | ||
| C. | 后者是前者的108倍 | D. | 后者是前者的1011倍 |