题目内容
16.常温下,下列各组离子一定能在指定溶液中大量共存的是( )| A. | 是酚酞变红色的溶液:K+、Fe3+、SO42-、Cl- | |
| B. | 水电离的c(H+)=1×10-13mol/L的溶液中:K+、Na+、AlO2-、CO32- | |
| C. | 与Al反应能放出H2的溶液中:Fe2+、Na+、NO3-、SO42- | |
| D. | $\frac{{K}_{W}}{c({H}^{+})}$=1×10-13mol/L的溶液中:NH4+、Cu2+、Cl-、NO3- |
分析 A.酚酞变红色的溶液中存在大量氢氧根离子,铁离子与氢氧根离子反应;
B.水电离的c(H+)=1×10-13mol/L的溶液中存在大量氢离子或氢氧根离子,偏铝酸根离子、碳酸根离子与氢离子反应;
C.与Al反应能放出H2的溶液中存在大量氢离子或氢氧根离子,亚铁离子与氢氧根离子,硝酸根离子在酸性条件下能够氧化亚铁离子;
D.该溶液中存在大量氢离子,四种两者之间不反应,都不与氢离子反应.
解答 解:A.酚酞变红色的溶液为碱性溶液,溶液中存在大量氢氧根离子,Fe3+与氢氧根离子反应,在溶液中不能大量共存,故A错误;
B.水电离的c(H+)=1×10-13mol/L的溶液为酸性或碱性溶液,AlO2-、CO32-与氢离子反应,在酸性溶液中不能大量共存,故B错误;
C.与Al反应能放出H2的溶液中存在大量氢离子或氢氧根离子,Fe2+与氢氧根离子反应,Fe2+、NO3-之间发生氧化还原反应,在溶液中不能大量共存,故C错误;
D.该溶液为酸性溶液,溶液中存在大量氢离子,NH4+、Cu2+、Cl-、NO3-之间不反应,都不与氢离子反应,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目
6.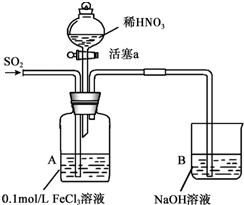 某化学小组探究酸性条件下NO3-、SO42-、Fe3+三种微粒的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).(忽略氧气对反应的影响)
某化学小组探究酸性条件下NO3-、SO42-、Fe3+三种微粒的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).(忽略氧气对反应的影响)
实验记录如下:
请回答下列问题:
(1)配制FeCl3溶液时,常常加入盐酸,目的是(用化学用语和简单文字叙述):铁离子水解:Fe3++3H2O Fe(OH)3+3H+,加入盐酸,增大c(H+),平衡左移,抑制Fe3+水解.
Fe(OH)3+3H+,加入盐酸,增大c(H+),平衡左移,抑制Fe3+水解.
(2)资料表明,Fe3+能与SO2结合形成深红棕色物质Fe(SO2)63+,反应方程式为:Fe3++6SO2?Fe(SO2)63+.请用化学平衡移动原理解释实验I中溶液颜色变化的原因Fe3+和SO2生成红棕色的Fe(SO2)63+反应速率较快:Fe3++6SO2 Fe(SO2)63+;而反应2Fe3++SO2+2H2O=2Fe2++SO42-+4H+反应缓慢,但是反应限度较大,使溶液中c(Fe3+)降低,平衡逆向移动,红棕色逐渐褪去,最终得到浅绿色溶液.
Fe(SO2)63+;而反应2Fe3++SO2+2H2O=2Fe2++SO42-+4H+反应缓慢,但是反应限度较大,使溶液中c(Fe3+)降低,平衡逆向移动,红棕色逐渐褪去,最终得到浅绿色溶液.
(3)实验II中发生反应的离子方程式是Ba2++SO42-=BaSO4↓.
(4)实验III中,浅绿色溶液变为黄色的原因是3Fe2++4H++NO3-=3Fe3++NO↑+2H2O.
(5)实验IV中液面上方有少量红棕色气体生成,发生反应的方程式是2NO+O2=2NO2.
(6)综合上述实验得出的结论是:在酸性条件下,氧化性强弱是:NO3->Fe3+>SO42-.请从微粒变化的角度解释实验II中溶液中检出Fe2+和SO42-,说明Fe3+氧化SO2生成SO42-,氧化性Fe3+>SO42-;实验III中溶液变黄色、IV中检出Fe3+和NO生成,说明酸性条件下NO3-氧化Fe2+,氧化性NO3->Fe3+;所以,在酸性条件下,氧化性强弱是:NO3->Fe3+>SO42-.
 某化学小组探究酸性条件下NO3-、SO42-、Fe3+三种微粒的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).(忽略氧气对反应的影响)
某化学小组探究酸性条件下NO3-、SO42-、Fe3+三种微粒的氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验).(忽略氧气对反应的影响)实验记录如下:
| 实验序号 | 实验操作 | 实验现象 |
| I | 向A装置中通入一段时间的SO2气体. | A中黄色溶液迅速变成深红棕色,最终变为浅绿色. |
| II | 取出少量A装置中的溶液,先加入KSCN溶液,再加入BaCl2溶液. | 加入KSCN溶液后溶液不变色,再加入BaCl2溶液产生白色沉淀. |
| III | 打开活塞a,将过量稀HNO3加入装置A中,关闭活塞a. | A中浅绿色溶液最终变为黄色. |
| IV | 取出少量A装置中的溶液,加入KSCN溶液;向A装置中注入空气. | 溶液变为红色;液面上方有少量红棕色气体生成. |
(1)配制FeCl3溶液时,常常加入盐酸,目的是(用化学用语和简单文字叙述):铁离子水解:Fe3++3H2O
 Fe(OH)3+3H+,加入盐酸,增大c(H+),平衡左移,抑制Fe3+水解.
Fe(OH)3+3H+,加入盐酸,增大c(H+),平衡左移,抑制Fe3+水解.(2)资料表明,Fe3+能与SO2结合形成深红棕色物质Fe(SO2)63+,反应方程式为:Fe3++6SO2?Fe(SO2)63+.请用化学平衡移动原理解释实验I中溶液颜色变化的原因Fe3+和SO2生成红棕色的Fe(SO2)63+反应速率较快:Fe3++6SO2
 Fe(SO2)63+;而反应2Fe3++SO2+2H2O=2Fe2++SO42-+4H+反应缓慢,但是反应限度较大,使溶液中c(Fe3+)降低,平衡逆向移动,红棕色逐渐褪去,最终得到浅绿色溶液.
Fe(SO2)63+;而反应2Fe3++SO2+2H2O=2Fe2++SO42-+4H+反应缓慢,但是反应限度较大,使溶液中c(Fe3+)降低,平衡逆向移动,红棕色逐渐褪去,最终得到浅绿色溶液.(3)实验II中发生反应的离子方程式是Ba2++SO42-=BaSO4↓.
(4)实验III中,浅绿色溶液变为黄色的原因是3Fe2++4H++NO3-=3Fe3++NO↑+2H2O.
(5)实验IV中液面上方有少量红棕色气体生成,发生反应的方程式是2NO+O2=2NO2.
(6)综合上述实验得出的结论是:在酸性条件下,氧化性强弱是:NO3->Fe3+>SO42-.请从微粒变化的角度解释实验II中溶液中检出Fe2+和SO42-,说明Fe3+氧化SO2生成SO42-,氧化性Fe3+>SO42-;实验III中溶液变黄色、IV中检出Fe3+和NO生成,说明酸性条件下NO3-氧化Fe2+,氧化性NO3->Fe3+;所以,在酸性条件下,氧化性强弱是:NO3->Fe3+>SO42-.
7.下列过程中颜色变化叙述正确的是( )
| A. | 湿润淀粉碘化钾试纸遇NO2变蓝 | B. | 溴化银见光分解变白 | ||
| C. | 热的氧化铜遇乙醇变绿 | D. | 苯酚遇石蕊试液变红 |
4.用NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,33.6LHF中含有氟原子的数目为1.5NA | |
| B. | 12g石墨和C60的混合物中质子总数为6NA | |
| C. | 在0.1mol•L-1的碳酸钠溶液中,阴离子总数一定大于0.lNA | |
| D. | 标准状况下,0.1mol己烷中共价键数目为19NA |
11.常温下,下列有关叙述正确的是( )
| A. | 在0.1mol/L Na2C2O4中:2c(Na+)═c(C2O42- )+c(HC2O4-)+c(H2C2O4) | |
| B. | 浓度均为0.1mol/L的小苏打溶液与烧碱溶液等体积混合:c(Na+)+c(H+)═2c(CO32-)+c(OH-)+c〔HCO3-) | |
| C. | 向10mL pH=l2的NaOH溶液中滴加等体积pH=2的CH3COOH:c(CH3COO-)>c(Na+)>c(OH-)>C(H+) | |
| D. | 0.2mol/L NaHCO3与0.1mol/L KOH溶液等体积混合:c(Na+)═2c(CO32-)+c〔HCO3-)+c(H2CO3) |
1.25℃时,用0.1mol•L-1的NaOH溶液滴定0.1mol•L-1CH3COOH(Ka=1.75×10-5)溶液过程中,消耗NaOH溶液的体积与溶液pH的关系如图所示,下列各项中微粒浓度间关系正确的是( )

| A. | 点①所示溶液中:2c(CH3COO-)-2c(CH3COOH)=c(H+)-c(OH-) | |
| B. | 点②所示溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| C. | 点③所示溶液中:c(CH3COO-)-c(CH3COOH)=c(Na+)+2c(H+)-2c(OH-) | |
| D. | pH=12的溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)>c(CH3COOH) |
8.以下金属的冶炼(“→”前为原料,“→”后为所得的金属),其中最适宜用热还原法冶炼的是( )
①MgCl2→Mg;②MnO2→Mn;③ZnO→Zn;④HgO→Hg;⑤磁铁矿→Fe;⑥KCl→K.
①MgCl2→Mg;②MnO2→Mn;③ZnO→Zn;④HgO→Hg;⑤磁铁矿→Fe;⑥KCl→K.
| A. | ①②④ | B. | ②③⑤ | C. | ②③⑤⑥ | D. | ①②③⑤ |
11.在25℃时,pH等于11的NaOH溶液和NaCN溶液中,水的电离度大小的比较正确的是( )
| A. | 两者相等 | B. | 前者比后者大11倍 | ||
| C. | 后者是前者的108倍 | D. | 后者是前者的1011倍 |