题目内容
17.下列说法正确的是( )| A. | 常温下镁铝表面能生成一层致密的氧化膜,保护内层的金属不被继续氧化 | |
| B. | 未打磨的铝箔因表面有氧化膜,因此在空气中加热后不能燃烧,若将氧化膜去除后再加热,则可在空气中燃烧 | |
| C. | 在化学反应中,由于铝原子能失去三个电子,而钠原子只能失去一个电子,所以铝的还原性比钠强 | |
| D. | 因铜是不活泼金属,故即使在潮湿的空气中也不会被腐蚀 |
分析 A、镁铝活泼极易被空气中的氧气氧化生成氧化膜;
B、燃烧是剧烈的氧化还原反应;
C、还原性强弱与失电子的多少无关,与失电子的难易难度有关;
D、铜在潮湿的空气中生成铜绿.
解答 解:A、镁铝活泼极易被空气中的氧气氧化生成氧化膜,而保护内层的金属不被继续氧化,故A正确;
B、加热铝条,未达着火点,不会燃烧,故B错误;
C、还原性强弱与失电子的多少无关,与失电子的难易难度有关,钠比铝易失电子,所以铝的还原性比钠弱,故C错误;
D、铜在潮湿的空气中生成铜绿,而被腐蚀,故D错误.
故选A.
点评 本题考查镁铝铜的性质,学生要清楚还原性强弱与失电子的多少无关,而与失电子的难度程度有关,比较容易.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
19.人造光卤石(KCl•MgCl2•6H2O)是盐化工的中间产物.以光卤石为原料制得金属镁,可有下列步骤,正确的顺序是( )
①过滤②溶解③加入适量Ca(OH)2④蒸发结晶⑤用盐酸溶解⑥电解熔融MgCl2⑦MgCl2•6H2O脱水.
①过滤②溶解③加入适量Ca(OH)2④蒸发结晶⑤用盐酸溶解⑥电解熔融MgCl2⑦MgCl2•6H2O脱水.
| A. | ⑤③①②④⑥⑦ | B. | ②③①⑤④⑦⑥ | C. | ②④①③⑦⑤⑥ | D. | ⑤③①④②⑦⑥ |
8.在氧化还原反应中,水既不作氧化剂又不作还原剂的是( )
| A. | CaO+H2O═Ca(OH)2 | B. | 2F2+2H2O═4HF+O2 | ||
| C. | 2Na+2H2O═2NaOH+H2↑ | D. | Cl2+H2O═HCl+HClO |
5.用0.2mol/L Na2SO3溶液32mL,还原含2×10-3 mol X2O72-的溶液,过量的Na2SO3用0.1mol/L KMnO4酸性溶液氧化(其中KMnO4被还原成Mn2+),共消耗KMnO4溶液1.6mL,则元素X在还原产物中的化合价是( )
| A. | +3 | B. | +4 | C. | +5 | D. | 0 |
12.0.1mol/L明矾溶液 100mL中,加入0.1mol/L的 Ba(OH)2溶液,当SO42-恰好沉淀完全时,同时得到的氢氧化铝的物质的量为( )
| A. | 0.01mol | B. | 0.005mol | C. | 0.0133mol | D. | 0.0mol |
2.如图装置可以组成原电池的是( )
| A. |  | B. |  | C. |  | D. |  |
9.下列物质性质变化规律正确的是( )
| A. | O、F、H的原子半径依次减小 | |
| B. | HClO4、H2SO4、H3PO4的酸性依次增强 | |
| C. | 干冰、钠、冰的熔点依次降低 | |
| D. | 金属Na、Mg、Al的硬度依次降低 |
6.下列化学用语正确的是( )
| A. | 乙烯的结构简式:CH2CH2 | B. | 乙醇的分子式:C2H5OH | ||
| C. | 乙酸的实验式:CH2O | D. | 苯的结构式: |
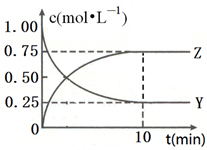 已知:2X(g)+Y(g)?a Z(g),在T1温度时,在体积为2L的密闭容器中,充入6mol X和2mol Y.根据图示回答:
已知:2X(g)+Y(g)?a Z(g),在T1温度时,在体积为2L的密闭容器中,充入6mol X和2mol Y.根据图示回答: