题目内容
12.0.1mol/L明矾溶液 100mL中,加入0.1mol/L的 Ba(OH)2溶液,当SO42-恰好沉淀完全时,同时得到的氢氧化铝的物质的量为( )| A. | 0.01mol | B. | 0.005mol | C. | 0.0133mol | D. | 0.0mol |
分析 0.1mol/L明矾溶液 100mL中KAl(SO4)2•12H2O为0.01mol,则溶液中含有0.01molK+、0.01molAl3+、0.02molSO42-,根据反应:SO42-+Ba2+═BaSO4↓,当溶液中的SO42-完全沉淀时,需要0.02molBa2+,即0.02molBa(OH)2,0.02molBa(OH)2中含有0.04molOH-,0.01molAl3+和0.04molOH-发生反应:Al3++4OH-═AlO2-+2H2O,据此进行解答.
解答 解:0.1mol/L明矾溶液 100mL中KAl(SO4)2•12H2O为0.01mol,则溶液中含有0.01molK+、0.01molAl3+、0.02molSO42-,根据反应:SO42-+Ba2+═BaSO4↓,当溶液中的SO42-完全沉淀时,需要0.02molBa2+,即0.02molBa(OH)2,0.02molBa(OH)2中含有0.04molOH-,0.01molAl3+和0.04molOH-发生反应:Al3++4OH-═AlO2-+2H2O,所以铝元素全部转化为偏铝酸盐,故选D.
点评 本题考查离子方程式的计算,题目难度中等,正确判断SO42-全部转化成BaSO4沉淀需要Ba(OH)2的物质的量为解答关键,注意明确铝离子与氢氧根离子反应特点,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
20.一定温度下,W g下列物质在足量氧气中充分燃烧,产物与过量的Na2O2完全反应,Na2O2固体增重W g,符合此要求的组合是( )
①H2 ②CO ③CO和H2④HCOOCH3⑤OHC-CHO.
①H2 ②CO ③CO和H2④HCOOCH3⑤OHC-CHO.
| A. | 只有① | B. | 只有①②③ | C. | 只有①②③④ | D. | 都可以 |
17.下列说法正确的是( )
| A. | 常温下镁铝表面能生成一层致密的氧化膜,保护内层的金属不被继续氧化 | |
| B. | 未打磨的铝箔因表面有氧化膜,因此在空气中加热后不能燃烧,若将氧化膜去除后再加热,则可在空气中燃烧 | |
| C. | 在化学反应中,由于铝原子能失去三个电子,而钠原子只能失去一个电子,所以铝的还原性比钠强 | |
| D. | 因铜是不活泼金属,故即使在潮湿的空气中也不会被腐蚀 |
4.化学科学需要借助化学专用语言描述,下列有关化学用语正确的是( )
| A. | Cl-的结构示意图  | B. | 铁红的化学式为Fe3O4 | ||
| C. | 甲醛的结构简式:CH2O | D. | CO2的电子式  |
2.2013年8月6日,中欧光伏产业谈判协议正式生效,为我国乃至世界新能源的发展起到极大的推动作用,晶体硅是光伏产业的重要材料.下列说法正确的是( )
| A. | 硅不能作为新能源开发的材料 | B. | 硅不可能与同主族的碳形成化合物 | ||
| C. | 二氧化硅属于离子化合物 | D. | 获取新能源不一定要发生化学变化 |
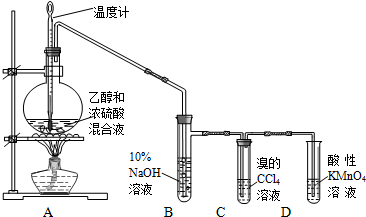 实验室制取乙烯并检验乙烯性质的装置如图.
实验室制取乙烯并检验乙烯性质的装置如图.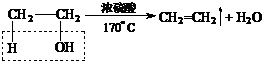 .
. ;
;