题目内容
5.氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用.请你根据所学知识回答下列问题:Ⅰ.把氯气缓慢通入紫色石蕊溶液中,可以观察到的现象是:紫色石蕊溶液先变成红色,然后颜色逐渐变浅,最后变为无色(红色退去).
请你解释其中的原因Cl2+H2O?HCl+HClO,盐酸有酸性,使紫色石蕊溶液先变成红色;HClO具有漂白性,使红色溶液褪色成无色溶液.
Ⅱ.某化学兴趣小组计划用氯气和氢氧化钠制取简易消毒液.
(1)其反应原理为:(用化学方程式表示)Cl2+2NaOH=NaCl+NaClO+H2O.
(2)实验室配制好4.0mol•L-1的NaOH溶液,这种溶液50mL才能与2.24L氯气(标准状况)恰好完全反应.
(3)配制250mL 4.0mol•L-1 NaOH溶液的实验步骤:
a.计算需要氢氧化钠固体的质量
b.称量氢氧化钠固体
c.将烧杯中的溶液注入容量瓶,并用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液也注入容量瓶.
d.用适量蒸馏水溶解称量好的氢氧化钠固体,静置冷却.
e.盖好瓶塞,反复上下颠倒,摇匀.
f.继续向容量瓶中加蒸馏水至刻度线下1cm~2cm时,改用胶头滴管加蒸馏水至凹液面与刻度线相切.
①用天平称量的所需氢氧化钠固体的质量是40.0g.
②上述步骤的正确操作顺序是a b d c f e.
③上述实验需要的玻璃仪器有烧杯、玻璃棒、胶头滴管、250mL容量瓶.
分析 I.氯气与水反应生成HClO,生成的HCl可使石蕊变红,HClO具有酸性和漂白性,现象是先变红后褪色;
Ⅱ.(1)氯气与NaOH反应生成NaCl、NaClO和水;
(2)根据氯气和氢氧化钠的关系式计算;
(3)结合m=cVM计算质量,配制溶液的步骤为:计算、称量、溶解、冷却、转移、洗涤、定容、摇匀、装瓶等,结合步骤分析使用的仪器.
解答 解:Ⅰ.氯气与水反应发生Cl2+H2O═HCl+HClO,具有酸性和漂白性,盐酸有酸性,使紫色石蕊溶液先变成红色;HClO具有漂白性,使红色溶液褪色成无色溶液,则氯气通入紫色石蕊溶液中,可以观察到的现象是紫色石蕊溶液先变成红色,然后颜色逐渐变浅,最后变为无色(红色退去),
故答案为:紫色石蕊溶液先变成红色,然后颜色逐渐变浅,最后变为无色(红色退去);Cl2+H2O?HCl+HClO,盐酸有酸性,使紫色石蕊溶液先变成红色;HClO具有漂白性,使红色溶液褪色成无色溶液;
Ⅱ.(1)氯气与NaOH溶液反应制备漂白液,反应原理为Cl2+2NaOH═NaCl+NaClO+H2O,
故答案为:Cl2+2NaOH═NaCl+NaClO+H2O;
(2)由反应Cl2+2NaOH═NaCl+NaClO+H2O可知,n(NaOH)=2n(Cl2)=2×$\frac{2.24L}{22.4L/mol}$=0.2mol,则V=$\frac{0.2mol}{4mol/L}$=0.5L=50mL,
故答案为:50
(3)①n(NaOH)=0.25L×4.0mol•L-1=1.0mol,m(NaOH)=1.0mol×40g•mol-1=40g,
故答案为:40g;
②配制溶液的步骤为:计算、称量、溶解、冷却、转移、洗涤、定容、摇匀、装瓶等,则正确的顺序为a、b、d、c、f、e,
故答案为:a、b、d、c、f、e;
③由上述实验步骤可知,需要的仪器为托盘天平、烧杯、玻璃棒、胶头滴管、250mL容量瓶、药匙,所以需要的玻璃仪器有:烧杯、玻璃棒、胶头滴管、250mL容量瓶,
故答案为:烧杯、玻璃棒、胶头滴管、250mL容量瓶.
点评 本题考查氯气的性质及溶液的配制,把握发生的化学反应及溶液配制的步骤为解答的关键,注重基础知识的考查,题目难度不大.

| A. | 该溶液的体积变为0.8L | B. | 该溶液的物质的量浓度为0.5mol/L | ||
| C. | 该溶液的物质的量为0.5mol | D. | 该溶液的物质的量浓度为0.4mol/L |
| A. | 氟氯烃是一类含氟和氯的卤代烃 | |
| B. | 氟氯烃的化学性质不稳定,有毒 | |
| C. | 氟氯烃大多数无色、无臭、无毒 | |
| D. | 在平流层,氟氯烃在紫外线照射下,分解产生的氯原子可引发损耗O3的循环反应 |
| A. | 用湿润的pH试纸测稀碱液的pH值,测定值偏小 | |
| B. | 用容量瓶配制溶液,定容时仰视刻度线,所配溶液浓度偏大 | |
| C. | 用盐酸标准溶液滴定未知浓度的NaOH溶液时,若滴定前滴定管内无气泡,终点读数时有气泡,则所测NaOH溶液的浓度偏大 | |
| D. | 测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏高 |
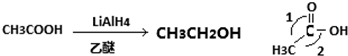
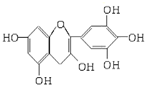 茶是我国的传统饮品,茶叶中含有的茶多酚可以替代食品添加剂中对人体有害的合成抗氧化剂,用于多种食品保鲜等,如图所示是茶多酚中含量最高的一种儿茶素A的结构简式,关于这种儿茶素A的有关叙述正确的是( )
茶是我国的传统饮品,茶叶中含有的茶多酚可以替代食品添加剂中对人体有害的合成抗氧化剂,用于多种食品保鲜等,如图所示是茶多酚中含量最高的一种儿茶素A的结构简式,关于这种儿茶素A的有关叙述正确的是( )