题目内容
11.某有机化合物D的结构为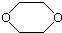 ,是一种常见的有机溶剂,它可以通过下列三步反应制得:
,是一种常见的有机溶剂,它可以通过下列三步反应制得:烃A$→_{①}^{Br_{2}}$B$→_{②}^{NaOH溶液}$C$→_{③}^{浓硫酸}$D,下列相关说法中正确的是( )
| A. | 烃A为CH3CH3 | B. | 反应②属于消去反应 | ||
| C. | 反应①②③都属于取代反应 | D. | 化合物D属于醚 |
分析 有机化合物D的结构为 ,由烃A$→_{①}^{Br_{2}}$B$→_{②}^{NaOH溶液}$C$→_{③}^{浓硫酸}$D及逆合成法可知,C为OHCH2CH2OH,B为BrCH2CH2Br,A为CH2=CH2,以此来解答.
,由烃A$→_{①}^{Br_{2}}$B$→_{②}^{NaOH溶液}$C$→_{③}^{浓硫酸}$D及逆合成法可知,C为OHCH2CH2OH,B为BrCH2CH2Br,A为CH2=CH2,以此来解答.
解答 解:有机化合物D的结构为 ,由烃A$→_{①}^{Br_{2}}$B$→_{②}^{NaOH溶液}$C$→_{③}^{浓硫酸}$D及逆合成法可知,C为OHCH2CH2OH,B为BrCH2CH2Br,A为CH2=CH2,
,由烃A$→_{①}^{Br_{2}}$B$→_{②}^{NaOH溶液}$C$→_{③}^{浓硫酸}$D及逆合成法可知,C为OHCH2CH2OH,B为BrCH2CH2Br,A为CH2=CH2,
A.烃A为乙烯,故A错误;
B.反应②中B发生水解反应生成醇,故B错误;
C.反应①为乙烯的加成反应,②③都属于取代反应,故C错误;
D.化合物D含醚键,属于醚,故D正确;
故选D.
点评 本题考查有机物的推断,为高频考点,把握有机物的性质、反应及逆合成法为解答的关键,侧重分析与应用能力的考查,注意有机反应中官能团的变化,题目难度不大.

练习册系列答案
相关题目
1.下列各组物质的性质比较,不正确的是( )
| A. | 酸性:HClO4>H2SO4>H3PO4>H2SiO3 | B. | 碱性:NaOH>Mg(OH)2>Al(OH)3 | ||
| C. | 热稳定性:PH3>H2S>HCl>H2O | D. | 非金属性:F>O>Cl>Br>I>S |
2.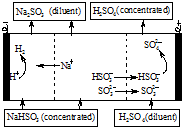 用NaOH溶液吸收SO2,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法.其中阴阳膜组合循环再生机理如图,则下列说法不正确的是( )
用NaOH溶液吸收SO2,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法.其中阴阳膜组合循环再生机理如图,则下列说法不正确的是( )
 用NaOH溶液吸收SO2,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法.其中阴阳膜组合循环再生机理如图,则下列说法不正确的是( )
用NaOH溶液吸收SO2,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法.其中阴阳膜组合循环再生机理如图,则下列说法不正确的是( )| A. | 阳极区酸性增强 | |
| B. | diluent和concentrated的中文含义为浓缩的、稀释的 | |
| C. | 阴极区连接的是阳离子交换膜 | |
| D. | 该过程中的副产品主要为H2SO4 |
19.常温下,浓度均为0.1mol.L-1的6种溶液pH如下:
请根据上表数据回答:
(1)常温下,相同物质的量浓度的下列稀溶液,其酸性由强到弱的顺序是B>C>D>A(用A、B、C、D表示).
A.H2SiO3 B.H2SO3 C.H2CO3 D.HClO
(2)若要增大氯水中次氯酸的浓度,可向氯水中加入上表中的物质是NaHCO3或NaClO(填化学式).
(3)请写出上述NaClO溶液中通入少量CO2的化学方程式:NaClO+CO2+H2O=HClO+NaHCO3.
(4)等浓度的H2SO3和NaHSO3混合液,加入少量的强酸或强碱溶液,pH值都没有明显变化,请解其原因:加碱时发生反应:H2SO3+OH-=HSO3-+H2O;加酸时发生反应:HSO3-+H+=H2SO3(用离子方程式表示).
| 溶质 | Na2CO3 | NaHCO3 | Na2SiO3 | Na2SO3 | NaHSO3 | NaClO |
| pH | 11.6 | 9.7 | 12.3 | 10.0 | 4.0 | 10.3 |
(1)常温下,相同物质的量浓度的下列稀溶液,其酸性由强到弱的顺序是B>C>D>A(用A、B、C、D表示).
A.H2SiO3 B.H2SO3 C.H2CO3 D.HClO
(2)若要增大氯水中次氯酸的浓度,可向氯水中加入上表中的物质是NaHCO3或NaClO(填化学式).
(3)请写出上述NaClO溶液中通入少量CO2的化学方程式:NaClO+CO2+H2O=HClO+NaHCO3.
(4)等浓度的H2SO3和NaHSO3混合液,加入少量的强酸或强碱溶液,pH值都没有明显变化,请解其原因:加碱时发生反应:H2SO3+OH-=HSO3-+H2O;加酸时发生反应:HSO3-+H+=H2SO3(用离子方程式表示).
6.在一定温度下的恒容密闭容器中,当下列哪些物理量不再发生变化时,表明下述反应:A(s)+2B(g)?C(g)+D(g)已达到平衡状态( )
①混合气体的压强
②混合气体的密度
③各气体物质的物质的量浓度
④气体的总物质的量
⑤混合气体的平均相对分子质量
⑥A 的质量.
①混合气体的压强
②混合气体的密度
③各气体物质的物质的量浓度
④气体的总物质的量
⑤混合气体的平均相对分子质量
⑥A 的质量.
| A. | ①②③⑥ | B. | ②③⑤⑥ | C. | ②③④⑤ | D. | ①③⑤⑥ |
16.下列有关实验的叙述正确的是( )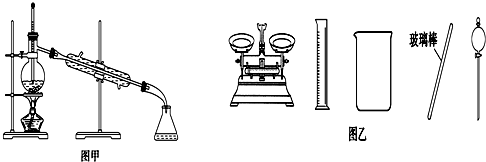

| A. | 可用碱式滴定管量取12.85 mL KMnO4溶液 | |
| B. | 实验室蒸馏石油可用如图甲所示实验装置 | |
| C. | 取用金属钠或钾时,没用完的钠或钾要放回原瓶 | |
| D. | 配制500 mL 0.4 mol•L-1 NaCl溶液,必要的仪器如图乙所示 |
3.下列离子方程式正确的是( )
| A. | 氧化铁和稀硫酸反应:Fe2O3+6H+=2Fe2++3H2O | |
| B. | 碳酸氢钠溶液中加稀硫酸:CO32-+2H+=H2O+CO2↑ | |
| C. | 氢氧化钡溶液加入稀硫酸中:OH-+H+ H2O | |
| D. | Cu(OH)2加入H2SO4:2H++Cu(OH)2=Cu2++2H2O |
7.图1曲线a和b是盐酸与氢氧化钠的相互滴定的滴定曲线,下列叙述不正确的是( )


| A. | 盐酸的物质的量浓度为1 mol•L-1,配制100 mL该溶液可用图3装置进行 | |
| B. | P点时反应恰好完全,溶液呈中性 | |
| C. | 曲线a是氢氧化钠溶液滴定盐酸的滴定曲线,可在图2的装置中进行 | |
| D. | 如果锥形瓶用待测液润洗,会使测定结果偏高 |
 =2Cr(OH)3↓+3O2↑+2H2O.
=2Cr(OH)3↓+3O2↑+2H2O.