题目内容
16.下列有关实验的叙述正确的是( )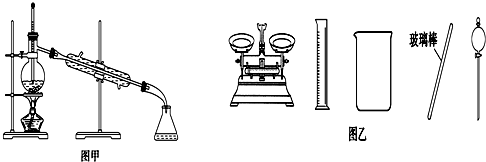
| A. | 可用碱式滴定管量取12.85 mL KMnO4溶液 | |
| B. | 实验室蒸馏石油可用如图甲所示实验装置 | |
| C. | 取用金属钠或钾时,没用完的钠或钾要放回原瓶 | |
| D. | 配制500 mL 0.4 mol•L-1 NaCl溶液,必要的仪器如图乙所示 |
分析 A.高锰酸钾可氧化橡胶;
B.蒸馏时温度计测定馏分的温度;
C.金属钠或钾时为活泼金属,易与水反应生成可燃性气体氢气;
D.配制500 mL 0.4 mol•L-1 NaCl溶液,一定需要500mL容量瓶,不需要分液漏斗.
解答 解:A.高锰酸钾可氧化橡胶,应选酸式滴定管量取12.85 mL KMnO4溶液,故A错误;
B.蒸馏时温度计测定馏分的温度,则温度计的水银球应在烧瓶的支管处,故B错误;
C.金属钠或钾时为活泼金属,易与水反应生成可燃性气体氢气,则没用完的钠或钾要放回原瓶,故C正确;
D.配制500 mL 0.4 mol•L-1 NaCl溶液,一定需要500mL容量瓶,不需要分液漏斗,则图中仪器不能配制溶液,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握仪器的使用、混合物分离提纯实验、溶液配制为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.某有机物X能发生水解反应,水解产物为Y和Z.同温同压下,相同质量的Y和Z的蒸气所占体积相同,化合物X可能是( )
| A. | 甲酸乙酯 | B. | 乙酸甲酯 | C. | 麦芽糖 | D. | 蔗糖 |
7.以氨气代替氢气来研发氨燃料电池是当前科研的一个热点.氨燃料电池使用的电解质溶液是KOH溶液,电池反应为:4NH3+3O2=2N2+6H2O有关下列说法错误的是( )
| A. | 氨燃料电池在放电时,氨气被氧化 | |
| B. | 氨燃料电池在放电时,正极反应为:2NH3+6e-+6OH-=N2+6H2O | |
| C. | 以氨气代替氢气的主要原因是:氨气易液化易储存 | |
| D. | 氨燃料电池产物为无污染的氮气和水,属于环境友好电池 |
4.主链含5个碳原子,有甲基、乙基 2 个支链的烷烃有( )
| A. | 2 种 | B. | 3 种 | C. | 4 种 | D. | 5 种 |
11.某有机化合物D的结构为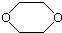 ,是一种常见的有机溶剂,它可以通过下列三步反应制得:
,是一种常见的有机溶剂,它可以通过下列三步反应制得:
烃A$→_{①}^{Br_{2}}$B$→_{②}^{NaOH溶液}$C$→_{③}^{浓硫酸}$D,下列相关说法中正确的是( )
 ,是一种常见的有机溶剂,它可以通过下列三步反应制得:
,是一种常见的有机溶剂,它可以通过下列三步反应制得:烃A$→_{①}^{Br_{2}}$B$→_{②}^{NaOH溶液}$C$→_{③}^{浓硫酸}$D,下列相关说法中正确的是( )
| A. | 烃A为CH3CH3 | B. | 反应②属于消去反应 | ||
| C. | 反应①②③都属于取代反应 | D. | 化合物D属于醚 |
1. 6种相邻短周期主族元素的相对位置如下表,M元素原子核外电子数是Y元素原子核外电子数的2倍,W元素原子的次外层电子数是最外层电子数的2倍.用化学用语回答下列问题:
6种相邻短周期主族元素的相对位置如下表,M元素原子核外电子数是Y元素原子核外电子数的2倍,W元素原子的次外层电子数是最外层电子数的2倍.用化学用语回答下列问题:
(1)Y在周期表中的位置是第二周期第VIA族.
(2)X、Y、Z三种元素的原子半径由大到小的顺序是r(N)>r(O)>r(F).
(3)W、M、Q三种元素最高价氧化物对应的水化物中,酸性由强到弱的顺序是HClO4>H2SO4>H2SiO3.
(4)W的最高价氧化物可以和Z的氢化物反应,利用该反应可刻蚀玻璃,反应的化学方程式是SiO2+4HF═SiF4+2H2O.
(5)X的含10个电子的气态氢化物甲是一种重要的化工原料.甲的电子式是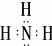 ,实验室制备甲的化学方程式是2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,甲可以与X的最高价氧化物对应的水化物溶液反应生成盐乙,乙溶液中的离子浓度由大到小的顺序是c(NO3-)>c(NH4+)>c(H+)>c(OH-).X的含18个电子的气态氢化物丙可与空气构成一种环保型碱性燃料电池,电池工作时丙发生的电极反应方程式是N2H4-4e-+4OH-═N2+4H2O.
,实验室制备甲的化学方程式是2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,甲可以与X的最高价氧化物对应的水化物溶液反应生成盐乙,乙溶液中的离子浓度由大到小的顺序是c(NO3-)>c(NH4+)>c(H+)>c(OH-).X的含18个电子的气态氢化物丙可与空气构成一种环保型碱性燃料电池,电池工作时丙发生的电极反应方程式是N2H4-4e-+4OH-═N2+4H2O.
(6)工业上用如图所示装置电 解Q元素的钠盐溶液丁,获得一种含Q元素的消毒剂.该反应的离子方程式是Cl-+H2O═ClO-+H2↑.
 6种相邻短周期主族元素的相对位置如下表,M元素原子核外电子数是Y元素原子核外电子数的2倍,W元素原子的次外层电子数是最外层电子数的2倍.用化学用语回答下列问题:
6种相邻短周期主族元素的相对位置如下表,M元素原子核外电子数是Y元素原子核外电子数的2倍,W元素原子的次外层电子数是最外层电子数的2倍.用化学用语回答下列问题:| X | Y | Z | |
| W | M | Q |
(2)X、Y、Z三种元素的原子半径由大到小的顺序是r(N)>r(O)>r(F).
(3)W、M、Q三种元素最高价氧化物对应的水化物中,酸性由强到弱的顺序是HClO4>H2SO4>H2SiO3.
(4)W的最高价氧化物可以和Z的氢化物反应,利用该反应可刻蚀玻璃,反应的化学方程式是SiO2+4HF═SiF4+2H2O.
(5)X的含10个电子的气态氢化物甲是一种重要的化工原料.甲的电子式是
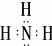 ,实验室制备甲的化学方程式是2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,甲可以与X的最高价氧化物对应的水化物溶液反应生成盐乙,乙溶液中的离子浓度由大到小的顺序是c(NO3-)>c(NH4+)>c(H+)>c(OH-).X的含18个电子的气态氢化物丙可与空气构成一种环保型碱性燃料电池,电池工作时丙发生的电极反应方程式是N2H4-4e-+4OH-═N2+4H2O.
,实验室制备甲的化学方程式是2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,甲可以与X的最高价氧化物对应的水化物溶液反应生成盐乙,乙溶液中的离子浓度由大到小的顺序是c(NO3-)>c(NH4+)>c(H+)>c(OH-).X的含18个电子的气态氢化物丙可与空气构成一种环保型碱性燃料电池,电池工作时丙发生的电极反应方程式是N2H4-4e-+4OH-═N2+4H2O.(6)工业上用如图所示装置电 解Q元素的钠盐溶液丁,获得一种含Q元素的消毒剂.该反应的离子方程式是Cl-+H2O═ClO-+H2↑.
8.在恒温恒容条件下,能使A(g)+2B(g)?C(g)+D (g) 正反应速率增大的措施是( )
| A. | 增大D的浓度 | B. | 减小C的浓度 | C. | 减小B的浓度 | D. | 减小压强 |
5.四种短周期元素在周期表中的相对位置如表所示,其中Z元素原子核外电子总数是其最外层电子数的3倍,下列说法正确的是( )
| X | Y | |
| Z | W |
| A. | 元素W位于第三周期第ⅤA族 | |
| B. | 元素Y的氢化物水溶液呈酸性 | |
| C. | 元素X、Z的各种氯化物分子中,各原子均满足8电子稳定结构 | |
| D. | 元素X与氢元素形成的原子个数比为1:1的化合物有多种 |