题目内容
下列叙述正确的是( )
| A、氕、氘、氚核外电子排布相同,都可作为核聚变的材料 |
| B、1 mol NH4+与23g Na+中含有的质子总数均为11×6.02×1023 |
| C、欲配制1.00 L 1.0 mol?L -1的NaCl溶液,可将58.5 g NaCl溶于1.00 L水中 |
| D、电解1 mol熔融的AlCl3,理论上能产生33.6L氯气(标准状况)、27.0g铝 |
考点:质子数、中子数、核外电子数及其相互联系,物质的量浓度的相关计算,电解原理
专题:物质的量浓度和溶解度专题,原子组成与结构专题
分析:A.氕、氘、氚是氢元素的三种核素,氘、氚可作为核聚变的材料;
B.根据微粒中质子数计算;
C.水的体积不等于溶于的体积;
D.氯化铝为共价化合物,熔融时不导电.
B.根据微粒中质子数计算;
C.水的体积不等于溶于的体积;
D.氯化铝为共价化合物,熔融时不导电.
解答:
解:A.氕、氘、氚是氢元素的三种核素,原子核外电子数相同,核外电子排布相同,氘、氚可作为核聚变的材料,故A错误;
B.一个NH4+与一个Na+中均含有的11个质子,则1 mol NH4+与23g Na+即1mol,含有的质子总数均为11×6.02×1023,故B正确;
C.欲配制1.00 L 1.0 mol?L -1的NaCl溶液,可将58.5 g NaCl溶于水配成1L溶于,但是水的体积不是1L,故C错误;
D.氯化铝为共价化合物,熔融时不导电,所以熔融的AlCl3不能发生电解反应,故D错误;
故选B.
B.一个NH4+与一个Na+中均含有的11个质子,则1 mol NH4+与23g Na+即1mol,含有的质子总数均为11×6.02×1023,故B正确;
C.欲配制1.00 L 1.0 mol?L -1的NaCl溶液,可将58.5 g NaCl溶于水配成1L溶于,但是水的体积不是1L,故C错误;
D.氯化铝为共价化合物,熔融时不导电,所以熔融的AlCl3不能发生电解反应,故D错误;
故选B.
点评:本题考查了原子和离子构成微粒关系、物质的量的计算、溶液配制、电解等,比较基础,注意基础知识的理解掌握.

练习册系列答案
相关题目
下列有关工业生产的叙述正确的是( )
| A、合成氨生产过程增大氮气浓度,可以同时提高N2、H2的转化率 |
| B、硫酸工业中,使用催化剂是为了提高SO2转化为SO3的转化率 |
| C、电解精炼铜时,阳极溶解的金属的质量与阴极析出的金属的质量不相等 |
| D、电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的Cl2进入阳极室 |
“信息”、“材料”和“能源”被称为新科技革命的三大支柱.下列有关资讯错误的是( )
| A、在即将到来的新能源时代,核能、太阳能、氢能将成为主要能源 |
| B、目前中美日等国掌握的陶瓷发动机技术,大大提高了发动机的能量转化效率 |
| C、2005年10月12日发射成功的“神舟六号”载人飞船使用了大量的复合材料 |
| D、合成高分子材料的广泛应用是有百利而无一害 |
下列有关晶体的说法中正确的是( )
| A、某晶体固态不导电,水溶液能导电说明该晶体是离子晶体 |
| B、原子晶体的原子间只存在共价键,而分子晶体内只存在范德华力 |
| C、区分晶体和非晶体最科学的方法是对固体进行X-射线衍射实验 |
| D、任何晶体中,若含有阳离子也一定含有阴离子 |
不能区别三氯化铁溶液和氢氧化铁胶体的方法有( )
| A、观察颜色 |
| B、丁达尔效应 |
| C、滴加浓的氯化钠溶液 |
| D、过滤实验 |
下列说法正确的是( )
| A、物质的量是指物质的质量 |
| B、物质的量和摩尔都是物理量 |
| C、摩尔是表示物质的量的单位 |
| D、CO2的摩尔质量是44g |
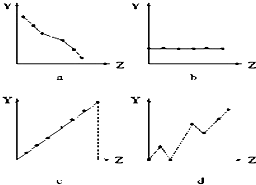 (1)如图曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质).把与下面元素有关的性质相符的曲线标号填入相应的空格中:
(1)如图曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质).把与下面元素有关的性质相符的曲线标号填入相应的空格中: