题目内容
12.下列用于硫酸铜结晶水含量测定的器具中名称正确的是( )| A. |  三脚架 | B. |  研钵 | C. |  镊子 | D. |  瓷坩埚 |
分析 硫酸铜结晶水含量测定过程中,选用用到的仪器有:托盘天平、研钵、酒精灯、瓷坩埚、三脚架、坩埚钳等,结合仪器的构造进行判断.
解答 解:A.该仪器的名称为泥三角,不是三脚架,故A错误;
B. 为研钵,名称与仪器的构造一致,故B正确;
为研钵,名称与仪器的构造一致,故B正确;
C.该仪器名称为坩埚钳,不是镊子,故C错误;
D.该仪器名称为坩埚,一般不称作瓷坩埚,故D错误;
故选B.
点评 本题考查了常见仪器的构造与名称的判断,题目难度不大,明确常见仪器的构造为解答关键,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案
相关题目
3.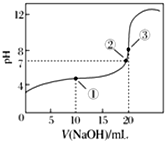 常温下,用0.100 0mol•L-1 NaOH溶液滴定20.00mL 0.100 0mol•L-1 CH3COOH溶液滴定曲线如图所示.下列说法正确的是( )
常温下,用0.100 0mol•L-1 NaOH溶液滴定20.00mL 0.100 0mol•L-1 CH3COOH溶液滴定曲线如图所示.下列说法正确的是( )
 常温下,用0.100 0mol•L-1 NaOH溶液滴定20.00mL 0.100 0mol•L-1 CH3COOH溶液滴定曲线如图所示.下列说法正确的是( )
常温下,用0.100 0mol•L-1 NaOH溶液滴定20.00mL 0.100 0mol•L-1 CH3COOH溶液滴定曲线如图所示.下列说法正确的是( )| A. | 点①所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-) | |
| B. | 点②所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-) | |
| C. | 点③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | |
| D. | 滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-) |
20. 某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:
某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:
(1)该实验应选用酚酞作指示剂,向锥形瓶中移取一定体积的白醋所用的仪器是酸式滴定管.(选填“酸式滴定管”或“碱式滴定管”)
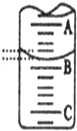
(2)如图表示25mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为15,滴定管中液面读数为15.40mL.设此时液体体积读数为amL,滴定管中液体的体积V大于(25-a)mL(选填“<”、“>”、“=”).
(3)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为a mol/L.三次实验结果记录如下:
从上表可以看出,第一次实验中记录消耗NaOH溶液体积明显多于后两次,其原因可能是BC.
A.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.盛装标准液的滴定管装液前用蒸馏水润洗后,未用标准液润洗
D.滴定NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(4)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(可以不化简):c=$\frac{a×\frac{20.32+20.28}{2}}{V}$ mol/L.
 某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:
某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:| 指示剂 | 甲基橙 | 甲基红 | 石蕊 | 酚酞 |
| 变色范围(pH) | 3.1-4.4 | 4.4-6.2 | 5.0-8.0 | 8.2-10.0 |
(2)如图表示25mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为15,滴定管中液面读数为15.40mL.设此时液体体积读数为amL,滴定管中液体的体积V大于(25-a)mL(选填“<”、“>”、“=”).
(3)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为a mol/L.三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 21.02 | 20.32 | 20.28 |
A.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.盛装标准液的滴定管装液前用蒸馏水润洗后,未用标准液润洗
D.滴定NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(4)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(可以不化简):c=$\frac{a×\frac{20.32+20.28}{2}}{V}$ mol/L.
17.草酸是二元弱酸,测得0.01mol•L-1草酸氢钠溶液显酸性.常温下向10mL 0.01mol•L-1 NaHC2O4溶液中滴加0.01mol•L-1 NaOH溶液,随着NaOH溶液体积的增加,下列说法正确的是( )
| A. | V(NaOH)=0时,c(Na+)>c(H+)>c(HC2O4- )>c(C2O42-)>c(OH-) | |
| B. | V(NaOH)=5 mL时,c(Na+)═c(C2O42-)+c(HC2O4- )+c(H2C2O4) | |
| C. | V(NaOH)=10 mL时,c(Na+)═c(HC2O4-)+c(C2O42-) | |
| D. | V(NaOH)>10 mL时,c(Na+)>c(C2O42-)>c(HC2O4- ) |
4.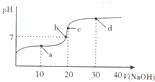 室温时,向20mL0.1mol•L-1的醋酸溶液中不断滴人0.1mol•L-1的NaOH溶液,溶液的pH变化曲线如图所示.在滴定过程中,关于溶液中离子浓度大小关系的描述不正确的是( )
室温时,向20mL0.1mol•L-1的醋酸溶液中不断滴人0.1mol•L-1的NaOH溶液,溶液的pH变化曲线如图所示.在滴定过程中,关于溶液中离子浓度大小关系的描述不正确的是( )
 室温时,向20mL0.1mol•L-1的醋酸溶液中不断滴人0.1mol•L-1的NaOH溶液,溶液的pH变化曲线如图所示.在滴定过程中,关于溶液中离子浓度大小关系的描述不正确的是( )
室温时,向20mL0.1mol•L-1的醋酸溶液中不断滴人0.1mol•L-1的NaOH溶液,溶液的pH变化曲线如图所示.在滴定过程中,关于溶液中离子浓度大小关系的描述不正确的是( )| A. | a点时:c( CH3COOH)>c( Na+)>c( CH3COO-)>c( H+)>c( OH -) | |
| B. | b点时:c( Na+)=c( CH3COO-)>c(H+)=c( OH-) | |
| C. | c点时:c(H+)=c(CH3COOH)+c( OH-) | |
| D. | d点时:c(Na+)>c(CH3COO -)>c(OH-)>c(H+) |
1.常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:
(1)从甲组情况分析,(填“能”或“不能”)不能判断HA是强酸还是弱酸.
(2)乙组混合溶液中离子浓度c(A-)和c(Na+)相等,则乙组混合溶液中存在3个动态平衡.
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是c(Na+ )>c(A- )>c( OH-)>c( H+)
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):
c(Na+)-c(A-)=10-4-10-10mol•L-1
(5)用离子方程式解释丁溶液pH=10的原因是A-+H2O?HA+OH-.
| 实验编号 | HA的物质的量 浓度(mol•L-1) | NaOH的物质的量 浓度(mol•L-1) | 混合后 溶液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.12 | 0.1 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=10 |
(2)乙组混合溶液中离子浓度c(A-)和c(Na+)相等,则乙组混合溶液中存在3个动态平衡.
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是c(Na+ )>c(A- )>c( OH-)>c( H+)
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):
c(Na+)-c(A-)=10-4-10-10mol•L-1
(5)用离子方程式解释丁溶液pH=10的原因是A-+H2O?HA+OH-.
 某研究性学习小组为了证明在同温同压下,相同浓度相同体积的酸性不同的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如图所示.该实验的主要操作步骤如下:
某研究性学习小组为了证明在同温同压下,相同浓度相同体积的酸性不同的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如图所示.该实验的主要操作步骤如下: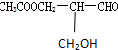 有光学活性,此分子中手性碳原子数目( )
有光学活性,此分子中手性碳原子数目( )