题目内容
11.已知90℃时,Kw=1.0×10-12,在90℃将pH=9的NaOH溶液与pH=4的硫酸溶液混合,若所得溶液pH=7,则NaOH溶液与硫酸溶液的体积比为( )| A. | 1:9 | B. | 9:1 | C. | 10:1 | D. | 1:10 |
分析 已知90℃时,Kw=1.0×10-12,pH=9的NaOH溶液中c(OH-)=$\frac{1{0}^{-12}}{1{0}^{-9}}$=10-3mol/L,pH=4的硫酸中c(H+)=10-4mol/L,若所得溶液pH=7,则c(OH-)=$\frac{1{0}^{-12}}{1{0}^{-7}}$=10-5mol/L,根据$\frac{c(O{H}^{-})×V(NaOH)-c({H}^{+})×V({H}_{2}S{O}_{4})}{V(NaOH)+V({H}_{2}S{O}_{4})}$=10-5计算氢氧化钠和硫酸的体积之比.
解答 解:已知90℃时,Kw=1.0×10-12,pH=9的NaOH溶液中c(OH-)=$\frac{1{0}^{-12}}{1{0}^{-9}}$=10-3mol/L,pH=4的硫酸中c(H+)=10-4mol/L,若所得溶液pH=7,则c(OH-)=$\frac{1{0}^{-12}}{1{0}^{-7}}$=10-5mol/L,根据$\frac{c(O{H}^{-})×V(NaOH)-c({H}^{+})×V({H}_{2}S{O}_{4})}{V(NaOH)+V({H}_{2}S{O}_{4})}$=$\frac{1{0}^{-3}×V(NaOH)-1{0}^{-4}×V({H}_{2}S{O}_{4})}{V(NaOH)+V({H}_{2}S{O}_{4})}$=10-5,则V(NaOH):V(H2SO4)=1:9,
故选A.
点评 本题考查了酸碱混合溶液的计算,明确溶液中c(OH-)、c(H+)与Kw的关系是解本题关键,题目难度中等,侧重于考查学生的分析能力和计算能力.

练习册系列答案
相关题目
13.实验测得常温下0.1mol/L某一元酸HA溶液的pH不等于l,0.1mol/L某一元碱BOH溶液里:$\frac{c({H}^{+})}{c(O{H}^{-})}$=10-12.将这两种溶液等体积混合后,所得溶液里各离子的物质的量浓度的关系正确的是( )
| A. | c(A-)>c(B+)>c(H+)>c(OH-) | B. | c(B+)>c(A-)>c(OH-)>c(H+) | ||
| C. | c(B+)+c (H+)>c(A-)+c(OH-) | D. | c(B+)>c(A-)>c(H+)>c(OH-) |
16. 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中;
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;
③向锥形瓶中滴入酚酞作指示剂,进行滴定.滴定至指示剂恰好变色,且30分钟不变化,测得所耗盐酸的体积为V1mL;
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL.
试回答下列问题:
(1)锥形瓶中的溶液从红色变为无色时,停止滴定.
(2)滴定时边滴边摇动锥形瓶,眼睛应观察B;
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
(3)该小组在步骤①中的错误是待测溶液润洗锥形瓶,由此造成的测定结果偏高 (填偏高、偏低或无影响);
(4)步骤②缺少的操作是用标准液润洗滴定管;
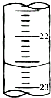
(5)如图,是某次滴定时的滴定管中的液面,其读数为22.60mL;
(6)根据如表数据:
请计算待测烧碱溶液的浓度为0.08 mol/L.
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中;
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;
③向锥形瓶中滴入酚酞作指示剂,进行滴定.滴定至指示剂恰好变色,且30分钟不变化,测得所耗盐酸的体积为V1mL;
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL.
试回答下列问题:
(1)锥形瓶中的溶液从红色变为无色时,停止滴定.
(2)滴定时边滴边摇动锥形瓶,眼睛应观察B;
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
(3)该小组在步骤①中的错误是待测溶液润洗锥形瓶,由此造成的测定结果偏高 (填偏高、偏低或无影响);
(4)步骤②缺少的操作是用标准液润洗滴定管;
(5)如图,是某次滴定时的滴定管中的液面,其读数为22.60mL;
(6)根据如表数据:
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 4.00 | 24.10 |
3.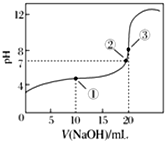 常温下,用0.100 0mol•L-1 NaOH溶液滴定20.00mL 0.100 0mol•L-1 CH3COOH溶液滴定曲线如图所示.下列说法正确的是( )
常温下,用0.100 0mol•L-1 NaOH溶液滴定20.00mL 0.100 0mol•L-1 CH3COOH溶液滴定曲线如图所示.下列说法正确的是( )
 常温下,用0.100 0mol•L-1 NaOH溶液滴定20.00mL 0.100 0mol•L-1 CH3COOH溶液滴定曲线如图所示.下列说法正确的是( )
常温下,用0.100 0mol•L-1 NaOH溶液滴定20.00mL 0.100 0mol•L-1 CH3COOH溶液滴定曲线如图所示.下列说法正确的是( )| A. | 点①所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-) | |
| B. | 点②所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-) | |
| C. | 点③所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | |
| D. | 滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-) |
20. 某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:
某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:
(1)该实验应选用酚酞作指示剂,向锥形瓶中移取一定体积的白醋所用的仪器是酸式滴定管.(选填“酸式滴定管”或“碱式滴定管”)
(2)如图表示25mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为15,滴定管中液面读数为15.40mL.设此时液体体积读数为amL,滴定管中液体的体积V大于(25-a)mL(选填“<”、“>”、“=”).
(3)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为a mol/L.三次实验结果记录如下:
从上表可以看出,第一次实验中记录消耗NaOH溶液体积明显多于后两次,其原因可能是BC.
A.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.盛装标准液的滴定管装液前用蒸馏水润洗后,未用标准液润洗
D.滴定NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(4)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(可以不化简):c=$\frac{a×\frac{20.32+20.28}{2}}{V}$ mol/L.
 某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:
某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:| 指示剂 | 甲基橙 | 甲基红 | 石蕊 | 酚酞 |
| 变色范围(pH) | 3.1-4.4 | 4.4-6.2 | 5.0-8.0 | 8.2-10.0 |
(2)如图表示25mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为15,滴定管中液面读数为15.40mL.设此时液体体积读数为amL,滴定管中液体的体积V大于(25-a)mL(选填“<”、“>”、“=”).
(3)为了减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为a mol/L.三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 21.02 | 20.32 | 20.28 |
A.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.盛装标准液的滴定管装液前用蒸馏水润洗后,未用标准液润洗
D.滴定NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(4)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(可以不化简):c=$\frac{a×\frac{20.32+20.28}{2}}{V}$ mol/L.
1.常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:
(1)从甲组情况分析,(填“能”或“不能”)不能判断HA是强酸还是弱酸.
(2)乙组混合溶液中离子浓度c(A-)和c(Na+)相等,则乙组混合溶液中存在3个动态平衡.
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是c(Na+ )>c(A- )>c( OH-)>c( H+)
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):
c(Na+)-c(A-)=10-4-10-10mol•L-1
(5)用离子方程式解释丁溶液pH=10的原因是A-+H2O?HA+OH-.
| 实验编号 | HA的物质的量 浓度(mol•L-1) | NaOH的物质的量 浓度(mol•L-1) | 混合后 溶液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.12 | 0.1 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=10 |
(2)乙组混合溶液中离子浓度c(A-)和c(Na+)相等,则乙组混合溶液中存在3个动态平衡.
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是c(Na+ )>c(A- )>c( OH-)>c( H+)
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):
c(Na+)-c(A-)=10-4-10-10mol•L-1
(5)用离子方程式解释丁溶液pH=10的原因是A-+H2O?HA+OH-.
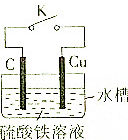 某同学为了探究原电池原理,设计如图所示装置:
某同学为了探究原电池原理,设计如图所示装置: