题目内容
14.下列有关溶液组成的描述合理的是( )| A. | 无色溶液中可能大量存在Al3+、NH4+、Cl?、HCO3- | |
| B. | 酸性溶液中可能大量存在Na+、IO3?、SO42-、I? | |
| C. | 碱性溶液中可能大量存在Na+、K+、SO32-、S2- | |
| D. | 中性溶液中可能大量存在Fe3+、K+、Cl?、SO42? |
分析 A.铝离子与碳酸氢根离子发生双水解反应生成氢氧化铝沉淀;
B.酸性条件下碘酸根离子与碘离子反应生成碘单质;
C.碱性溶液中,四种离子之间不发生反应;
D.铁离子只能存在于酸性溶液中.
解答 解:A.Al3+与HCO3-发生互促水解,生成氢氧化铝和二氧化碳,故A错误;
B.酸性溶液中IO3-、I-会发生反应IO3-+5I-+6H+=3I2+3H2O,在溶液中不能大量共存,故B错误;
C.S2-与SO32?在酸性溶液中发生SO32?+2S2-+6H+=3S↓+3H2O而不能大量共存,但在碱性溶液中不发生反应,可以大量共存,故C正确;
D.在pH=3.2左右时,Fe3+会以氢氧化铁沉淀形式析出,在中性溶液中Fe3+不会存在,故D错误;
故选C.
点评 本题考查离子共存的正误判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”等;试题侧重对学生基础知识的训练和检验,有利于提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
4.四种短周期元素在周期表中的相对位置如下所示,其中Z元素最外层电子数是其电子层数的2倍.请回答下列问题:
(1)元素Z位于周期表中的位置第三周期第ⅥA族.
(2)实验室制取X元素的简单氢化物的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(3)硒是人体必需的微量元素,与Y同主族,硒原子比Y原子多两个电子层,则硒的原子序数34.
(4)将过量的W的单质通入FeBr2的溶液中,发生反应的离子方程式2Fe2++4Br-+3Cl2=2Fe3++2 Br2+6Cl-.
| X | Y | |
| Z | W |
(2)实验室制取X元素的简单氢化物的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(3)硒是人体必需的微量元素,与Y同主族,硒原子比Y原子多两个电子层,则硒的原子序数34.
(4)将过量的W的单质通入FeBr2的溶液中,发生反应的离子方程式2Fe2++4Br-+3Cl2=2Fe3++2 Br2+6Cl-.
2.下列实验装置设计正确、且能达到目的是( )
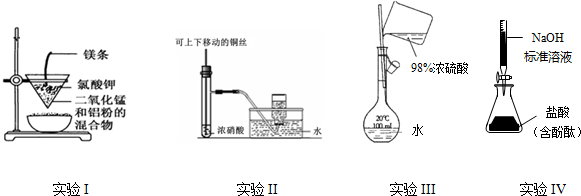

| A. | 实验I:制备金属锰 | |
| B. | 实验II:制备并收集NO2 | |
| C. | 实验III:配置一定的物质的量浓度的稀硫酸溶液 | |
| D. | 实验IV:测定未知盐酸的浓度 |
6.下列物质转化在给定条件下不能一步实现的是( )
| A. | 饱和NaCl(aq)$\stackrel{NH_{3},CO_{2}}{→}$ NaHCO3$\stackrel{△}{→}$Na2CO3 | |
| B. | Mg3N2$\stackrel{H_{2}O}{→}$Mg(OH)2$\stackrel{△}{→}$MgO | |
| C. | Mg$→_{加热}^{SO_{2}}$MgO | |
| D. | MgCl2(aq)$\stackrel{蒸发浓缩}{→}$MgCl2•6H2O$\stackrel{熔融电解}{→}$Mg |
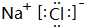 .
. .
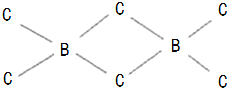
.
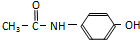 )是常用的消炎解热镇痛药.其合成路线如下:
)是常用的消炎解热镇痛药.其合成路线如下:
 →
→ 的反应类型为还原反应.
的反应类型为还原反应.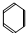 →
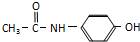
→ 反应实验时添加试剂的顺序为加入浓硝酸,再加入浓硫酸,最后加入苯.
反应实验时添加试剂的顺序为加入浓硝酸,再加入浓硫酸,最后加入苯. 与
与 的性质相似,写出一定条件下
的性质相似,写出一定条件下 与NaOH溶液反应的化学方程式
与NaOH溶液反应的化学方程式 .
. 的同分异构体有3种.
的同分异构体有3种. )是重要的化工中间体,工业上以邻二甲苯和甘氨酸(H2N-CH2-COOH)为原料通过一系列的反应制取该化合物,请参照上述流程的相关信息,写出最后一步反应的化学方程式.
)是重要的化工中间体,工业上以邻二甲苯和甘氨酸(H2N-CH2-COOH)为原料通过一系列的反应制取该化合物,请参照上述流程的相关信息,写出最后一步反应的化学方程式.