题目内容
5.A、B、C、D、E为五种原子序数依次增大的短周期主族元素.已知B的最外层电子数与核外电子总数之比为3:4;D的最外层电子数与次外层电子数之比为3:4;E-、C-、A-的半径逐渐减小;常温下化合物AE为气体.请回答下列问题:
(1)D、E的最高价氧化物对应水化物酸性较强的是HClO4(写化学式).
(2)写出CD形成的化合物的电子式
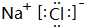 .
.(3)A与B、A与D均可形成18电子分子,这两种分子在水溶液中反应有黄色沉淀生成,写出该反应的化学方程式:H2O2+H2S=2H2O+S↓.
(4)化合物乙、丙均为由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比为1:1:1,乙为强碱,丙为盐类,丙为常见家用消毒剂的主要成分.则化合物乙中的化学键类型为离子键、共价键;则丙的化学式是NaClO.
分析 A、B、C、D、E为五种原子序数依次增大的短周期主族元素.已知B的最外层电子数与核外电子总数之比为3:4,短周期元素内层电子数为2或10,令B元素的最外层电子数为x,则x:(x+2)=3:4,x=6或x:(10+x)=3:4,x=30,不存在,故B为氧元素;D的最外层电子数与次外层电子数之比为3:4,短周期次外层电子数为2或8,D的次外层电子数只能为8,故D有3个电子层,最外层电子数为6,D为硫元素;E原子序数最大,为主族元素,则E为Cl元素;E-、C+、A+的半径逐渐减小,C、A形成+1价离子,处于第ⅠA族,常温下化合物AE为气体,故A为氢元素,C的原子序数大于氧元素,则C为Na元素.
(1)非金属性越强最高价含氧酸酸性越强;
(2)C、D形成的化合物NaCl,由钠离子与氯离子构成;
(3)A与B、A与D均可形成18电子分子分别为H2O2、H2S,两者反应氧化还原反应得到单质硫与水;
(4)化合物乙、丙均为强电解质,且乙为强碱,丙为盐类,丙为常见家用消毒剂的主要成分,则乙为NaOH,丙为NaClO.
解答 解:A、B、C、D、E为五种原子序数依次增大的短周期主族元素.已知B的最外层电子数与核外电子总数之比为3:4,短周期元素内层电子数为2或10,令B元素的最外层电子数为x,则x:(x+2)=3:4,x=6或x:(10+x)=3:4,x=30,不存在,故B为氧元素;D的最外层电子数与次外层电子数之比为3:4,短周期次外层电子数为2或8,D的次外层电子数只能为8,故D有3个电子层,最外层电子数为6,D为硫元素;E原子序数最大,为主族元素,则E为Cl元素;E-、C+、A+的半径逐渐减小,C、A形成+1价离子,处于第ⅠA族,常温下化合物AE为气体,故A为氢元素,C的原子序数大于氧元素,则C为Na元素.
(1)非金属性Cl>S,非金属性越强最高价含氧酸酸性越强,故酸性HClO4>H2SO4,
故答案为:HClO4;
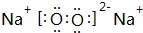
(2)C、D形成的化合物NaCl,由钠离子与氯离子构成,电子式为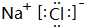 ,
,
故答案为: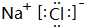 ;
;
(3)A与B、A与D均可形成18电子分子分别为H2O2、H2S,两者反应氧化还原反应得到单质硫与水,反应方程式为:H2O2+H2S=2H2O+S↓,
故答案为:H2O2+H2S=2H2O+S↓;
(4)化合物乙、丙均为强电解质,且乙为强碱,丙为盐类,乙为NaOH,含有离子键、共价键,丙为常见家用消毒剂的主要成分,应为NaClO,
故答案为:离子键、共价键;NaClO.
点评 本题考查结构性质位置关系、元素周期律、核外电子排布规律、常用化学用语等,难度中等,推断元素是解题的关键,注意对元素化合物性质的掌握.

| A. | 氨水 | B. | NaNO3溶液 | C. | 盐酸 | D. | Na2CO3溶液 |
| A. | 0.1 mol | B. | 0.2 mol | C. | 0.3 | D. | 0.4 mol |
| A. | 用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| B. | 用双氧水和稀硫酸处理印刷电路板:Cu+H2O2+2H+=Cu2++2H2O | |
| C. | NaHCO3溶液中加足量Ba(OH)2溶液:2HCO3-+Ba2++2OH-=BaCO3↓+H2O+CO32- | |
| D. | 氯气溶于水:Cl2+H2O=2H++Cl-+ClO- |
| A. | 无色溶液中可能大量存在Al3+、NH4+、Cl?、HCO3- | |
| B. | 酸性溶液中可能大量存在Na+、IO3?、SO42-、I? | |
| C. | 碱性溶液中可能大量存在Na+、K+、SO32-、S2- | |
| D. | 中性溶液中可能大量存在Fe3+、K+、Cl?、SO42? |
| A. | 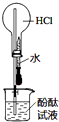 如图实验可观察到红色喷泉 | |
| B. | 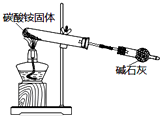 如图实验可制取少量氨气 | |
| C. | 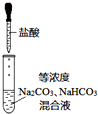 如图实验中逐滴滴加稀盐酸时,试管中立即产生大量气泡 | |
| D. | 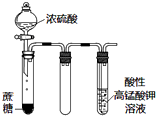 如图实验中酸性KMnO4溶液中有大量气泡出现,但溶液颜色不变 |
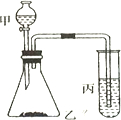 比较硫、碳、硅的非金属性由强到弱的顺序,请从下列给出的试剂中选择合理的实验试剂,利用所给装置验证你的结论(提示:难溶于水).实验试剂:浓盐酸、稀H2SO4、饱和Na2SO3溶液、大理石、Na2CO3粉末、Na2SiO3溶液.实验装置:如图所示
比较硫、碳、硅的非金属性由强到弱的顺序,请从下列给出的试剂中选择合理的实验试剂,利用所给装置验证你的结论(提示:难溶于水).实验试剂:浓盐酸、稀H2SO4、饱和Na2SO3溶液、大理石、Na2CO3粉末、Na2SiO3溶液.实验装置:如图所示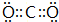 ,
,
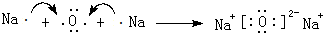 .
.