题目内容
6.下列物质转化在给定条件下不能一步实现的是( )| A. | 饱和NaCl(aq)$\stackrel{NH_{3},CO_{2}}{→}$ NaHCO3$\stackrel{△}{→}$Na2CO3 | |
| B. | Mg3N2$\stackrel{H_{2}O}{→}$Mg(OH)2$\stackrel{△}{→}$MgO | |
| C. | Mg$→_{加热}^{SO_{2}}$MgO | |
| D. | MgCl2(aq)$\stackrel{蒸发浓缩}{→}$MgCl2•6H2O$\stackrel{熔融电解}{→}$Mg |
分析 A、根据侯氏制碱法来分析;
B、Mg2N3在水中水水解为Mg(OH)2,Mg(OH)2受热分解为MgO和水;
C、镁在二氧化硫中燃烧生成MgO和硫;
D、氯化镁溶液经过蒸发浓缩后得到的是氢氧化镁而不是MgCl2•6H2O.
解答 解:A、向饱和氯化钠溶液中通入氨气和二氧化碳后有碳酸氢钠晶体析出,过滤得NaHCO3晶体,NaHCO3晶体加热得Na2CO3晶体,故可以一步实现,故A正确;
B、Mg2N3在水中水水解为NH3和Mg(OH)2,Mg(OH)2受热分解为MgO和水,故均可以一步实现,故B正确;
C、镁在二氧化硫中燃烧生成MgO和硫,可以一步实现,故C正确;
D、氯化镁溶液经过蒸发浓缩后得到的是氢氧化镁而不是MgCl2•6H2O,若要得到金属镁,需加热熔融的MgCl2,故均不能一步实现,故D错误.
故选D.
点评 本题考查化合物的性质,题目难度不大,熟练掌握物质的性质是解决此类问题的关键,正确运用物质分类及反应规律则是解决此类问题的有效方法.

练习册系列答案
 小题狂做系列答案
小题狂做系列答案
相关题目
14.下列有关溶液组成的描述合理的是( )
| A. | 无色溶液中可能大量存在Al3+、NH4+、Cl?、HCO3- | |
| B. | 酸性溶液中可能大量存在Na+、IO3?、SO42-、I? | |
| C. | 碱性溶液中可能大量存在Na+、K+、SO32-、S2- | |
| D. | 中性溶液中可能大量存在Fe3+、K+、Cl?、SO42? |
11.下列反应的离子方程式书写正确的是( )
| A. | 在偏铝酸钠溶液中滴入少量的碳酸氢钠溶液HCO3-+AlO2-+H2O=Al(OH)3↓+CO2↑ | |
| B. | 向明矾溶液中逐滴加入Ba(OH)2溶液至Al3+离子刚好完全沉淀2Al3++6OH-+3Ba2++3SO42-=2Al(OH)3↓+3BaSO4↓ | |
| C. | 在碳酸氢镁溶液中逐滴加入澄清石灰水至过量Ca2++Mg2++2HCO3-+2OH-=CaCO3↓+2H2O+MgCO3↓ | |
| D. | 氢氧化铁固体溶于氢碘酸 Fe(OH)3+3H+=Fe3++3H2O |
15.利用如图所示装置进行实验,下列说法正确的是( )
| A. | 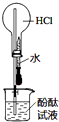 如图实验可观察到红色喷泉 | |
| B. | 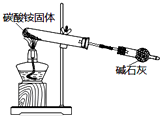 如图实验可制取少量氨气 | |
| C. | 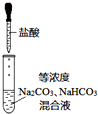 如图实验中逐滴滴加稀盐酸时,试管中立即产生大量气泡 | |
| D. | 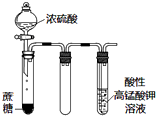 如图实验中酸性KMnO4溶液中有大量气泡出现,但溶液颜色不变 |
16.战国所著《周礼》中记载沿海古人“煤饼烧蛎房成灰”(“蛎房”即牡蛎壳),并把这种灰称为“蜃”.蔡伦改进的造纸术,第一步沤浸树皮脱胶的碱液可用“蜃”溶于水制得.“蜃”的主要成分是( )
| A. | CaO | B. | NaHCO3 | C. | SiO2 | D. | CaCO3 |
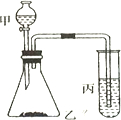 比较硫、碳、硅的非金属性由强到弱的顺序,请从下列给出的试剂中选择合理的实验试剂,利用所给装置验证你的结论(提示:难溶于水).实验试剂:浓盐酸、稀H2SO4、饱和Na2SO3溶液、大理石、Na2CO3粉末、Na2SiO3溶液.实验装置:如图所示
比较硫、碳、硅的非金属性由强到弱的顺序,请从下列给出的试剂中选择合理的实验试剂,利用所给装置验证你的结论(提示:难溶于水).实验试剂:浓盐酸、稀H2SO4、饱和Na2SO3溶液、大理石、Na2CO3粉末、Na2SiO3溶液.实验装置:如图所示