题目内容
12.在由铜片、铁片和250mL稀H2SO4组成的原电池中,若铜片上放出4.48L(标准状况下)的H2,H2SO4恰好用完,则产生这些气体消耗的Fe的质量为多少?原稀H2SO4的物质的量浓度为多少?分析 原电池总反应式为:Fe+H2SO4=FeSO4+H2↑,计算氢气物质的量,根据方程式计算Fe、硫酸的物质的量,再根据m=nM计算Fe的质量,根据c=$\frac{n}{V}$计算硫酸的物质的量浓度.
解答 解:生成氢气为$\frac{4.48L}{22.4L/mol}$=0.2mol
设消耗Fe、硫酸物质的量分别为x、y,则:
Fe+H2SO4=FeSO4+H2↑
1 1 1
x y 0.2mol
则x=y=$\frac{0.1mol×1}{1}$=0.1mol
故消耗Fe的质量为0.1mol×56g/mol=5.6g
硫酸的物质的量浓度为$\frac{0.1mol}{0.25L}$=0.4mol/L,
答:消耗Fe的质量为5.6g,硫酸的物质的量浓度0.4mol/L.
点评 本题考查原电池的有关计算,比较基础,明确反应的反应即可解答,旨在考查学生对基础知识的巩固.

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
2.下列叙述不能判断某化学平衡一定发生移动的是( )
| A. | 反应体系的温度改变 | |
| B. | 反应混合物中各组分的百分含量改变 | |
| C. | 正、逆反应速率改变 | |
| D. | 反应物的物质的量改变 |
3.甲~辛等元素在周期表中的位置如下表所示.下列说法正确的是( )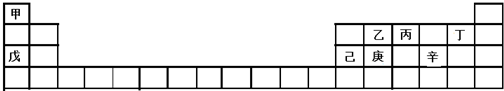

| A. | 甲、戊、己的单质都是金属 | |
| B. | 乙、丙、丁的氢化物稳定性依次增强 | |
| C. | 庚的氧化物不能和丁的氢化物反应 | |
| D. | 己的氧化物能分别与戊和辛的最高价氧化物的水化物反应 |
20.分子量为58的烷烃一氯代物共有几种( )
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
7.现有部分短周期元素的性质或原子结构如表:
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是146C,在周期表中的位置是第二周期 IVA族.
(2)元素Y与氢元素形成一种离子YH4+,写出该离子与Z离子形成化合物的电子式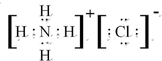 .
.
(3)写出元素X、T形成的化合物XT2的电子式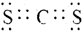 .
.
(4)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是b、d、e(填序号)
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
d.与铁加热,Z生成三价铁,T生成二价铁
e.T原子与Z原子电子层数相同,Z原子半径小于T原子
(5)T的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为SO2+Cl2+2H2O=2HCl+H2SO4
(6)分别用电子式表示Z与镁元素、Y与氮元素形成化合物的过程: ,
,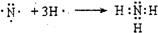 .
.
| 元素编号 | 元素性质或原子结构 |
| T | 最外层电子数比内层电子总数少4 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 与氢形成的气态化合物在标准状况下的密度为0.76g•L-1 |
| Z | 元素最高正价与负价的绝对值之差是6 |
(2)元素Y与氢元素形成一种离子YH4+,写出该离子与Z离子形成化合物的电子式
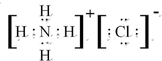 .
.(3)写出元素X、T形成的化合物XT2的电子式
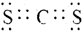 .
.(4)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是b、d、e(填序号)
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
d.与铁加热,Z生成三价铁,T生成二价铁
e.T原子与Z原子电子层数相同,Z原子半径小于T原子
(5)T的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为SO2+Cl2+2H2O=2HCl+H2SO4
(6)分别用电子式表示Z与镁元素、Y与氮元素形成化合物的过程:
 ,
,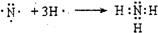 .
.
17.已知氮原子的质量数为14,则在NH3D1中,电子数、质子数、中子数之比为( )
| A. | 10:7:11 | B. | 11:11:8 | C. | 11:10:8 | D. | 10:11:8 |
4.化学与生活密切相关,下列说法不正确的是( )
| A. | “青篙一握,以水二升渍,绞取汁”,该过程是对青篙素的提取,属于化学变化 | |
| B. | 向漂白粉溶液中滴加少量醋酸,漂白速率会加快 | |
| C. | 利用生物方法脱除生活污水中的氮和磷,可防止水体富营养化 | |
| D. | 中国古代利用明矾溶液的酸性清除铜镜表面的铜锈 |
15.某小组探究Cl2的制备方法和相关性质设计如下实验.请回答下列问题:
(1)实验室用装置A制备C12的化学方程式为4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)①实验室在没有浓盐酸情况下,常用浓硫酸、食盐和二氧化锰在加热条件下制取氯气,则氧化剂与还原剂的质量之比为29:39.
②某研究性学习小组在查阅相关资料时发现二氧化锰与浓硫酸在加热条件下可产生O2和MnS04,其反应方程式为2Mn02+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$2MnSO4+O2↑+2H20.
③选用如图所示装置(装置可重复使用)和适当试剂,依次验证氯水的酸性、漂白性和氧化性,并证明制备C12时生成了O2.
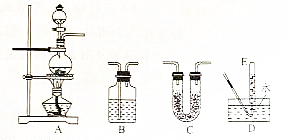
供选试剂:MnO2、浓硫酸、食盐、饱和食盐水、紫色石蕊试液、酚酞试液、KBr溶液和CCl4的混合液、碱石灰、蒸馏水.将所用装置或仪器的序号按连接顺序由上至下依次填入下表,并写出该仪器中应加试剂的名称或化学式.
④证明有氧气生成的操作及现象是将D收集的气体用带火星的木条检验,如果带火星的木条复燃,则证明是氧气.
⑤实验结束后,振荡盛有KBr溶液和CCl4的混合溶液的洗气瓶,现象为溶液分层,上层无色,下层为橙色.
(1)实验室用装置A制备C12的化学方程式为4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)①实验室在没有浓盐酸情况下,常用浓硫酸、食盐和二氧化锰在加热条件下制取氯气,则氧化剂与还原剂的质量之比为29:39.
②某研究性学习小组在查阅相关资料时发现二氧化锰与浓硫酸在加热条件下可产生O2和MnS04,其反应方程式为2Mn02+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$2MnSO4+O2↑+2H20.
③选用如图所示装置(装置可重复使用)和适当试剂,依次验证氯水的酸性、漂白性和氧化性,并证明制备C12时生成了O2.

供选试剂:MnO2、浓硫酸、食盐、饱和食盐水、紫色石蕊试液、酚酞试液、KBr溶液和CCl4的混合液、碱石灰、蒸馏水.将所用装置或仪器的序号按连接顺序由上至下依次填入下表,并写出该仪器中应加试剂的名称或化学式.
| 选用的仪器 | 加入的试剂 |
| A | 二氧化锰、浓硫酸、食盐 |
| B | 饱和食盐水 |
| B | KBr溶液和CCl4的混合液 |
| D |
⑤实验结束后,振荡盛有KBr溶液和CCl4的混合溶液的洗气瓶,现象为溶液分层,上层无色,下层为橙色.
16.下列关于化学用语的表述正确的是( )
| A. | HClO的结构式:H-O-Cl | B. | 纯碱的化学式为:Na2CO3 | ||
| C. | 原子核内有8个中子的碳原子148C | D. | Na2O2电子式为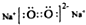 |