题目内容
15.常温下,下列各组离子在指定溶液中一定能大量共存的是( )| A. | 饱和氯水中 Br-、NO3-、Na+、SO32- | |
| B. | 由水电离出的C(H+)=1×10 -12 mol•L-1的溶液:K+、Ba2+、HCO3-、Cl- | |
| C. | 0.1 mol•L-1FeCl3溶液:K+、NH4+、NO3-、SO42- | |
| D. | c(H+)/c(OH-)=1×10 -12的溶液:Ca2+、Fe3+、ClO-、NO3- |
分析 A.氯水具有酸性和强氧化性;
B.由水电离出的C(H+)=1×10 -12 mol•L-1的溶液可能呈酸性或碱性;
C.与铁离子反应的离子不能大量共存;
D.c(H+)/c(OH-)=1×10 -12的溶液呈碱性.
解答 解:A.氯水具有酸性和强氧化性,具有还原性的SO32-不能大量共存,故A错误;
B.由水电离出的C(H+)=1×10 -12 mol•L-1的溶液可能呈酸性或碱性,无论呈酸性还是碱性,HCO3-都不能大量共存,故B错误;
C.离子之间不发生任何反应,可大量共存,故C正确;
D.c(H+)/c(OH-)=1×10 -12的溶液呈碱性,碱性条件下Fe3+不能大量共存,且Fe3+、ClO-发生互促水解反应,故D错误.
故选C.
点评 本题考查离子的共存,为高考高频考点,侧重复分解反应、氧化还原反应、水解反应的离子共存的考查,注意把握习题中的信息及常见离子之间的反应,题目难度不大.

练习册系列答案
相关题目
3.反应C(s)+H2O(g)?CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
| A. | 增加C的量 | |
| B. | 将容器的体积缩小一半 | |
| C. | 保持体积不变,充入一定量的H2O(g) | |
| D. | 保持压强不变,充入N2使容器体积变大 |
10.下列有关金属的用途,其中利用的是金属的化学性质的是( )
| A. | 铜--电线 | B. | 铝--反射镜 | ||
| C. | 铁--回收溶液中的银 | D. | 不锈钢--炊具 |
20.常温下,甲、乙、丙三位同学用实验确定某酸HA是弱电解质的方案分别是:
甲:用pH试纸测定0.1moI/L HA溶液的pH,即可证明HA是弱电解质.
乙:①分别取pH=l的HA溶液和稀盐酸各10.00mL,再加水稀释为100mL:
②各取相同体积的两种稀释液(适量),同时分别加入纯度和形状大小均相同的锌粒(足量),观察现象,即可证明HA是弱电解质.
丙:将适量的HA溶液和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,分析表中数据可以说明HA是弱电解质.
(1)甲的方案中,说明HA是弱电解质的理由是测得溶液的pH>1(填“>”、“<”或“=”).甲进行实验时的具体操作方法是先把一小块pH试纸放在表面皿或玻璃片上,再用玻璃棒蘸取溶液点在试纸的中部,待变色后,与标准比色卡对比确定溶液的pH.
(2)在乙的方案的第①步中,需要用到的定量仪器是酸式滴定管.pH均为1的HA溶液和稀盐酸中,水的电离程度的大小关系是c(填字母).
a.HA溶液中水的电离程度大
b.稀盐酸中水的电离程度大
c.两种溶液中水的电离程度相同
(3)乙的方案中,说明HA是弱电解质的主要现象是B(填字母).
A.装稀盐酸的试管中放出H2的速率快
B.装HA溶液的试管中放出H2的速率快
C.两个试管中产生气体的速率一样快
(4)丙的方案中,编号②中的c>(填“>”、“<”或“=”)0.l,该混合液中的离子浓度:c(Na+)=(填“>”、“<”或“=”)c(A-).
(5)丙的方案中,编号③的数据表明,混合溶液中HA的电离程度比NaA的水解程度:强(填“强”、“弱”或“无法确定”).
甲:用pH试纸测定0.1moI/L HA溶液的pH,即可证明HA是弱电解质.
乙:①分别取pH=l的HA溶液和稀盐酸各10.00mL,再加水稀释为100mL:
②各取相同体积的两种稀释液(适量),同时分别加入纯度和形状大小均相同的锌粒(足量),观察现象,即可证明HA是弱电解质.
丙:将适量的HA溶液和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,分析表中数据可以说明HA是弱电解质.
| 编号 | NaOH/mol•L-1 | HA/mol•L-1 | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.1 | 0.2 | pH<7 |
(2)在乙的方案的第①步中,需要用到的定量仪器是酸式滴定管.pH均为1的HA溶液和稀盐酸中,水的电离程度的大小关系是c(填字母).
a.HA溶液中水的电离程度大
b.稀盐酸中水的电离程度大
c.两种溶液中水的电离程度相同
(3)乙的方案中,说明HA是弱电解质的主要现象是B(填字母).
A.装稀盐酸的试管中放出H2的速率快
B.装HA溶液的试管中放出H2的速率快
C.两个试管中产生气体的速率一样快
(4)丙的方案中,编号②中的c>(填“>”、“<”或“=”)0.l,该混合液中的离子浓度:c(Na+)=(填“>”、“<”或“=”)c(A-).
(5)丙的方案中,编号③的数据表明,混合溶液中HA的电离程度比NaA的水解程度:强(填“强”、“弱”或“无法确定”).
7.下列关于元素周期表中递变规律的说法正确的是( )
| A. | 同主族元素从上到下,单质的熔点逐渐降低 | |
| B. | 同周期主族元素离子半径从左到右依次减小 | |
| C. | HF、HCl、HBr、HI 的热稳定性依次减弱,还原性和水溶液的酸性依次增强 | |
| D. | 第三周期非金属元素含氧酸的酸性从左到右依次增强 |
4.在元素周期表中,周期的划分依据是( )
| A. | 元素原子的核电荷数 | B. | 元素的化合价 | ||
| C. | 元素原子的电子层数 | D. | 元素原子的最外层电子数 |
5.下列有关实验的操作正确的是( )
| 实验 | 操作 | |
| A | 制取氢氧化铁胶体 | 向沸腾的蒸馏水中按适当比例滴加FeCl3饱和溶液,继续加热至液体呈红褐色,停止加热 |
| B | 稀释浓硫酸 | 先将浓硫酸加入烧杯中,后倒入蒸馏水 |
| C | 浓氨水与生石灰反应制备干燥的NH3 | 气体产物通过浓硫酸后,用向下排空气法收集 |
| D | 分离乙酸乙酯和饱和碳酸钠溶液 | 从分液漏斗上口倒出有机层,再从下口放出水层 |
| A. | A | B. | B | C. | C | D. | D |
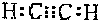 .
.