题目内容
7.下列关于元素周期表中递变规律的说法正确的是( )| A. | 同主族元素从上到下,单质的熔点逐渐降低 | |
| B. | 同周期主族元素离子半径从左到右依次减小 | |
| C. | HF、HCl、HBr、HI 的热稳定性依次减弱,还原性和水溶液的酸性依次增强 | |
| D. | 第三周期非金属元素含氧酸的酸性从左到右依次增强 |
分析 A.第ⅦA族元素的单质从上到下,单质的熔点逐渐升高;
B.金属离子失去电子后失去1个电子层,则同一周期中金属离子的半径较小;
C.非金属性F>Cl>Br>I,非金属性越强,氢化物稳定性越强,还原性越弱,酸溶液的酸性越弱;
D.同一周期中,原子序数越大,最高价氧化物对应水合物的酸性越强,题中中没有指明“最高价”.
解答 解:A.第ⅠA族元素的单质从上到下,单质的熔点逐渐降低,第ⅦA族元素的单质从上到下,单质的熔点逐渐升高;
B.同周期主族元素中金属元素的离子半径小于非金属元素的阴离子半径,故B错误;
C.非金属性F>Cl>Br>I,则氢化物HF、HCl、HBr、HI 的热稳定性依次减弱,还原性和水溶液的酸性依次增强,故C正确;
D.同一周期中,非金属元素的最高价含氧酸的酸性从左到右依次增强,题中中没有指明“最高价”,故D错误;
故选C.
点评 本题考查了原子结构与元素周期律的关系,题目难度不大,涉及单质熔点、离子半径大小比较、氢化物稳定性、还原性强弱比较、最高价含氧酸酸性强弱判断等知识,明确元素周期律内容为解答关键,试题有利于提高学生的灵活应用能力.

练习册系列答案
相关题目
15.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 饱和氯水中 Br-、NO3-、Na+、SO32- | |
| B. | 由水电离出的C(H+)=1×10 -12 mol•L-1的溶液:K+、Ba2+、HCO3-、Cl- | |
| C. | 0.1 mol•L-1FeCl3溶液:K+、NH4+、NO3-、SO42- | |
| D. | c(H+)/c(OH-)=1×10 -12的溶液:Ca2+、Fe3+、ClO-、NO3- |
12.常温下,用0.100 0 mol•L-1NaOH溶液滴定20.00 mL 0.1 000 mol•L-1CH3COOH溶液.当滴入NaOH溶液为20.00 mL时溶液显碱性,溶液中各离子浓度关系正确的是( )
| A. | c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | B. | c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | ||
| C. | c(Na+)+c(H+)=c(CH3COO-)+c(OH-) | D. | c(Na+)+c(OH-)=c(CH3COO-)+c(H+) |
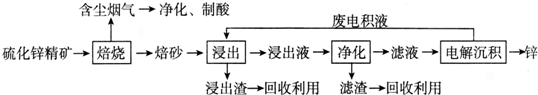
17.α-铁纳米粉在现代电子工业上用途极为广泛,用赤铁矿石(含Fe2O3、FeO,也含有Al2O3、MnO2、CuO等)制备纳米铁颗粒的实验流程如下:
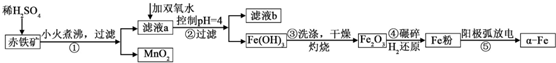
已知:部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
(1)步骤②中用pH试纸测定溶液pH的操作是将一小块pH试纸放在表面皿上,用玻璃棒蘸取少量待测液,点在pH试纸上,再与标准比色卡对照.步骤②滤液中含有的金属阳离子是Cu2+、Al3+,步骤④中碾碎的目的是增大接触面积,提高原料的转化率和反应速率.
(2)将第①步过滤所得的MnO2与KClO3、KOH溶液共热,可得到K2MnO4,此反应的化学方程式是3MnO2+6KOH+KClO3=3 K2MnO4+KCl+3H2O.
(3)步骤③灼烧所需的仪器有酒精灯、三脚架、泥三角、坩埚、坩埚钳.
(4)若步骤⑤是利用电弧加热使金属熔融蒸发成蒸汽,使大量颗粒状烟灰尘与周围X气体原子激烈碰撞进行充分的能量交换和电荷交换生成α-Fe,X气体可以为c.
a.O2b.N2c.Hed.H2
(5)“纳米铁”在空气中受撞击时会燃烧,其反应与铁在纯氧中燃烧相同,写出该反应的化学方程式3Fe+2O2$\frac{\underline{\;撞击\;}}{\;}$Fe3O4.

已知:部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 6.7 |
(2)将第①步过滤所得的MnO2与KClO3、KOH溶液共热,可得到K2MnO4,此反应的化学方程式是3MnO2+6KOH+KClO3=3 K2MnO4+KCl+3H2O.
(3)步骤③灼烧所需的仪器有酒精灯、三脚架、泥三角、坩埚、坩埚钳.
(4)若步骤⑤是利用电弧加热使金属熔融蒸发成蒸汽,使大量颗粒状烟灰尘与周围X气体原子激烈碰撞进行充分的能量交换和电荷交换生成α-Fe,X气体可以为c.
a.O2b.N2c.Hed.H2
(5)“纳米铁”在空气中受撞击时会燃烧,其反应与铁在纯氧中燃烧相同,写出该反应的化学方程式3Fe+2O2$\frac{\underline{\;撞击\;}}{\;}$Fe3O4.
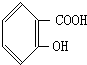 、
、 、
、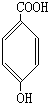
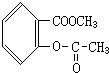 、
、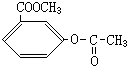 、
、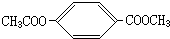 .
.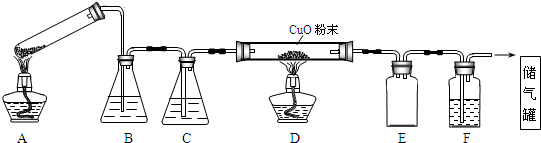
 已知二氧化硫可使高锰酸钾溶液褪色反应的化学方程式为:5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4
已知二氧化硫可使高锰酸钾溶液褪色反应的化学方程式为:5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+2H2SO4