题目内容
5.以下说法正确的是( )| A. | 将pH=4的醋酸溶液稀释后,H+浓度增大 | |
| B. | 常温下,0.01L pH=10的NaOH溶液加水稀释到10L,此时溶液的pH=7 | |
| C. | 改变条件使醋酸的电离平衡向右移动,醋酸的电离度一定增大 | |
| D. | 常温下0.1mol•L-1醋酸溶液的pH=a,加入适量的醋酸钠固体能使溶液pH=(a+1) |
分析 A.pH=4醋酸稀释促进电离,但其电离增大采用小于溶液体积增大程度;
B.常温下,0.01LpH=10的NaOH溶液加水稀释到10L,溶液接近中性;
C.醋酸电离平衡正向移动,但醋酸电离程度不一定增大;
D.醋酸钠抑制醋酸电离.
解答 解:A.pH=4醋酸稀释促进电离,但其电离增大采用小于溶液体积增大程度,所以溶液中H+浓度减小,故A错误;
B.碱性溶液稀释pH只能无限接近于中性,但不可能呈中性,故B错误;
C.增大醋酸浓度,平衡右移,但电离度减小,故C错误;
D.醋酸钠抑制醋酸电离,溶液的pH增大,所以常温下0.1mol•L-1醋酸溶液的pH=a,加入适量的醋酸钠固体能使溶液pH=(a+1),故D正确;
故选D.
点评 本题考查弱电解质的电离、盐类水解等知识点,为高频考点,侧重考查学生分析判断能力,知道弱酸浓度与其电离程度关系,易错选项是B,注意酸或碱无论如何稀释都不能变为中性溶液,只能是接近中性,题目难度不大.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
15.以NA代表阿伏加德罗常数,则关于热化学方程式:C2H2(g)+$\frac{5}{2}$O2(g)═2CO2(g)+H2O(l)△H=-1300kJ/mol的说法中,正确的是( )
| A. | 当有10NA个电子转移时,该反应放出1300kJ的能量 | |
| B. | 当有10NA个碳氧共用电子对生成时,放出1300kJ的能量 | |
| C. | 当有2NA个碳氧共用电子对生成时,放出1300kJ的能量 | |
| D. | 当有1NA个水分子生成且为液体时,吸收1300kJ的能量 |
20.下列离子方程式书写正确的是( )
| A. | 在100 mL 1 mol•L-1的 Fe(NO3)3的溶液中通入足量SO2:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ | |
| B. | 在100 mL 2 mol•L-1的FeI2的溶液中通入标况下5.6 L的Cl2:4Fe2++6I-+5Cl2═4Fe3++3I2+10Cl- | |
| C. | 向NaHCO3溶液中加入过量的澄清石灰水:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- | |
| D. | 向明矾溶液中加入过量的氢氧化钡溶液:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O |
10.下列化学用语书写正确的是( )
| A. | S2-离子的结构示意图: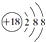 | B. | H2O2的电子式: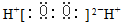 | ||
| C. | CO2的比例模型: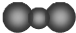 | D. | 有8个质子、10个中子的核素:188O |
17.实验室有一包白色固体,可能含有Na2CO3、NaCl和Na2SO3中的一种或多种.下列根据实验事实得出的结论正确的是( )
| A. | 称取18.0g固体,在空气中充分灼烧,质量增加1.6g;另取18.0g固体溶于足量稀盐酸,充分反应后,得到标况下气体3.36L(气体全部逸出),说明固体中一定含NaCl | |
| B. | 取一定量固体,溶解,向溶液中滴加适量AgNO3溶液,观察到有白色沉淀生成,说明原固体中一定含有NaCl | |
| C. | 取一定量固体,溶解,向溶液中滴加足量盐酸溶液,观察到有气体产生,将产生的气体通入澄清石灰水中变浑浊,说明原固体中一定含有Na2CO3 | |
| D. | 取一定量固体,溶解,向溶液中滴加适量Ca(NO3)2 溶液,观察到产生白色沉淀,说明原固体中一定含有Na2CO3 |
14.下列实验操作能实现符合题中要求的是( )
| A. | 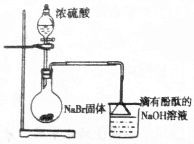 能证明制取HBr的现象使烧杯中红色褪去 | |
| B. | 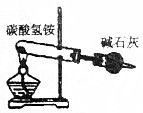 实验室可用此装置制取氨气 | |
| C. | 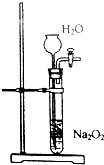 可以用于实验室制取氧气 | |
| D. | 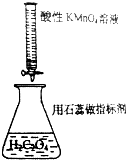 用KMnO4滴定H2C2O4 |
2.能在空气中稳定保存的物质是( )
| A. | 氢氧化亚铁 | B. | 过氧化钠 | C. | 镁条 | D. | 氯水 |