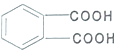
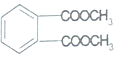
题目内容
20.已知常温下浓度为0.1mol/L的几种溶液的pH如表.下列有关说法正确的是( )| 溶质 | pH |
| NaF | 7.5 |
| Na2CO3 | 11.6 |
| NaClO | 9.7 |
| NaHCO3 | 8.3 |
| A. | 同温度同浓度下,酸由强到弱的顺序为:HF>H2CO3>HClO | |
| B. | 水解方程式:F-+H2O?HF+OH-的平衡常数为1×10-13 | |
| C. | 将CO2通入0.lmol/LNa2CO3溶液至溶液呈中性,则溶液中:2c(CO32-)+c(HCO3-)=0.1mol/L | |
| D. | 等物质的量的NaF和HF混合溶液中粒子浓度大小关系为:c(HF)>c(Na+)>c(F-)>c (H+)>c(OH-) |
分析 A、相同浓度的钠盐溶液碱性越强,说明酸根离子水解程度越大,则相应酸的酸性越弱;
B.水解方程式F-+H2O?HF+OH-的平衡常数为K=$\frac{c(HF)c({OH}^{-})}{c(F-)}$;
C.溶液为中性时:c(H+)=c(OH-),根据电荷守恒可知:2c(CO32-)+c(HCO3-)=c(Na+);
D、如果离子浓度符合c(Na+)>c(F-)>c (H+)>c(OH-),则溶液中电荷不守恒.
解答 解:A、相同浓度的钠盐溶液碱性越强,说明酸根离子水解程度越大,则相应酸的酸性越弱,同浓度NaF、NaClO、NaHCO3的PH分别为:7.5、9.7、8.3,所以酸由强到弱的顺序为:HF>H2CO3>HClO,故A正确;
B.F-+H2O?HF+OH-的平衡常数为K=$\frac{c(HF)c({OH}^{-})}{c(F-)}$=$\frac{1{0}^{-6.5}×1{0}^{-6.5}}{0.1}$=10-12,故B错误;
C.若将CO2通入0.1mol/L Na2CO3溶液至溶液中性,则c(H+)=c(OH-),根据电荷守恒可知:2c(CO32-)+c(HCO3-)=c(Na+)=0.2mol/L,故C错误;
D、如果离子浓度符合c(Na+)>c(F-)>c (H+)>c(OH-),则溶液中电荷不守恒,故D错误;
故选A.
点评 本题考查了离子浓度大小比较,题目难度中等,正确判断溶液酸性强弱为解答关键,注意掌握电荷守恒、物料守恒及盐的水解原理的含义及应用方法,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11.有下列五种说法:①使离子相结合或原子相结合的作用力,叫做化学键;②两个非金属原子间不可能形成离子键;③非金属原子间不可能形成离子化合物;④离子化合物中不能存在共价键;⑤某化合物的水溶液能导电,则该化合物中一定存在离子键,其中正确的是( )
| A. | ①② | B. | ②③④ | C. | ②④⑤ | D. | ①②③④⑤ |
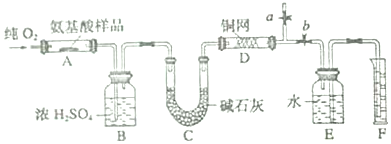
8.氯化亚铁具有独有的脱色能力,适用于染料、染料中间体、印染、造纸行业的污水处理.某课题小组设计如下方案制备氯化亚铁并探究氯化亚铁(Fe2+)的还原性.
某同学选择下列装置用氯化铁制备少量氯化亚铁(装置不可以重复使用).查阅资料知,氯化铁遇水剧烈水解,在加热条件下氢气还原氯化铁生成FeCl2.

(1)实验开始前应先检查装置的气密性,请叙述装置A气密性检验的方法:关闭活塞,向长颈漏斗内注水至形成一段水柱且液面高度不变,说明装置气密性良好
(2)气流从左至右,装置接口连接顺序是ab c e f d
(3)装置C中干燥管中所盛试剂的名称是:碱石灰或生石灰,作用是:除去HCl、并防止空气中水的进入
(4)装置D中发生的化学方程式是:2FeCl3+H2$\frac{\underline{\;\;△\;\;}}{\;}$2HCl+2FeCl2
(5)为了测定氯化亚铁的质量分数,某同学进行了如下实验:
称取实验制备的氯化亚铁样品5.435g,配成溶液,用1.00mol•L-1酸性KMnO4标准溶液滴定至终点.(已知还原性Fe2+>Cl-)滴定结果如表所示:
①写出滴定过程中所发生的2个离子方程式MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O,2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O
②样品中氯化亚铁的质量分数为70.1%.
某同学选择下列装置用氯化铁制备少量氯化亚铁(装置不可以重复使用).查阅资料知,氯化铁遇水剧烈水解,在加热条件下氢气还原氯化铁生成FeCl2.

(1)实验开始前应先检查装置的气密性,请叙述装置A气密性检验的方法:关闭活塞,向长颈漏斗内注水至形成一段水柱且液面高度不变,说明装置气密性良好
(2)气流从左至右,装置接口连接顺序是ab c e f d
(3)装置C中干燥管中所盛试剂的名称是:碱石灰或生石灰,作用是:除去HCl、并防止空气中水的进入
(4)装置D中发生的化学方程式是:2FeCl3+H2$\frac{\underline{\;\;△\;\;}}{\;}$2HCl+2FeCl2
(5)为了测定氯化亚铁的质量分数,某同学进行了如下实验:
称取实验制备的氯化亚铁样品5.435g,配成溶液,用1.00mol•L-1酸性KMnO4标准溶液滴定至终点.(已知还原性Fe2+>Cl-)滴定结果如表所示:
| 滴定次数 | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | |
| 1 | 1.04 | 25.03 |
| 2 | 1.98 | 25.99 |
| 3 | 3.20 | 25.24 |
②样品中氯化亚铁的质量分数为70.1%.
15.光照条件下,甲烧与氯气在容积不变的密闭容器中可发生反应: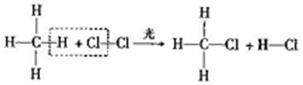
下到说法错误的是( )
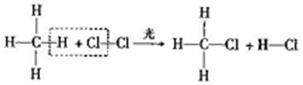
下到说法错误的是( )
| A. | 该反应中三种元素的非金属性:Cl>C>H | |
| B. | 该反应中有两种旧化学键断裂,同时有两种新化学键形成 | |
| C. | 该反应中,反应物和生成物中均只含共价键 | |
| D. | 该反应中,反应物和生成物均为共价化合物 |
5.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 所含共价键数均为0.4NA的白磷(P4)和甲烷的物质的量相等 | |
| B. | 10g浓度为46%的乙醇水溶液中含有的氢原子总数为1.2NA | |
| C. | 2 g H2分别与足量的C12和N2充分反应后转移的电子数均为2NA | |
| D. | 1molFe(OH)3与含3molHI的溶液完全反应后,溶液中所含I-的数目为3NA |
9.设NA为阿伏伽德罗常数的数值.下列有关叙述正确的是( )
| A. | pH=1的硫酸溶液中含有的SO42-数目为0.05NA | |
| B. | 100g质量分数为46%的乙醇溶液中所含的氢原子数为12NA | |
| C. | 100mL 1mol/L CH3COONa 溶液中含有的CH3COO-数目为0.1NA | |
| D. | 0.2molNH3与0.3molO2在催化剂的作用下加热充分反应,所得NO的分子数为0.2NA |

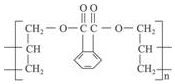 DAP是电器和仪表部件中常用的一种合成髙分子化合物(结构简式如图),合成此该高分子的单体可能是( )
DAP是电器和仪表部件中常用的一种合成髙分子化合物(结构简式如图),合成此该高分子的单体可能是( )