题目内容
15.光照条件下,甲烧与氯气在容积不变的密闭容器中可发生反应: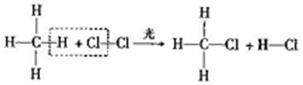
下到说法错误的是( )
| A. | 该反应中三种元素的非金属性:Cl>C>H | |
| B. | 该反应中有两种旧化学键断裂,同时有两种新化学键形成 | |
| C. | 该反应中,反应物和生成物中均只含共价键 | |
| D. | 该反应中,反应物和生成物均为共价化合物 |
分析 A.高氯酸的酸性大于碳酸的酸性,甲烷中C为负价;
B.该反应为化学变化;
C.只有非金属性元素;
D.反应物中氯气为单质.
解答 解:A.高氯酸的酸性大于碳酸的酸性,甲烷中C为负价,可知非金属性为Cl>C>H,故A正确;
B.该反应为化学变化,则断裂C-H、Cl-Cl键,形成C-Cl、H-Cl键,故B正确;
C.只有非金属性元素,四种物质含化学键均为共价键,故C正确;
D.反应物中氯气为单质,其它为共价化合物,故D错误;
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握元素周期律、化学键为解答的关键,侧重分析与迁移应用能力的考查,注意选项A为解答的难点,题目难度不大.

练习册系列答案
 同步奥数系列答案
同步奥数系列答案
相关题目
6.下列关于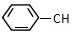 =CHCH3的说法不正确的是( )
=CHCH3的说法不正确的是( )
 =CHCH3的说法不正确的是( )
=CHCH3的说法不正确的是( )| A. | 分子式为C9H10 | B. | 该有机物的一氯代物有5种 | ||
| C. | 能使酸性高锰酸钾溶液褪色 | D. | 所有碳原子不可能在同一平面上 |
3.下列转化中,碳原子间的连接形式未发生改变的是( )
| A. | 丁酮的催化加氢反应 | B. | 丙酮与HCN发生加成反应 | ||
| C. | 乙醛与乙醛反应生成2-羟基丁醛 | D. | 乙苯与酸性高锰酸钾溶液反应 |
10. 向0.1mol/L的Al2( SO4)3溶液中滴加1.0mol/L的NaOH溶液,滴加过程中溶液pH随NaOH溶液体积变化的曲线如图所示.下列分析不正确的是( )
向0.1mol/L的Al2( SO4)3溶液中滴加1.0mol/L的NaOH溶液,滴加过程中溶液pH随NaOH溶液体积变化的曲线如图所示.下列分析不正确的是( )
 向0.1mol/L的Al2( SO4)3溶液中滴加1.0mol/L的NaOH溶液,滴加过程中溶液pH随NaOH溶液体积变化的曲线如图所示.下列分析不正确的是( )
向0.1mol/L的Al2( SO4)3溶液中滴加1.0mol/L的NaOH溶液,滴加过程中溶液pH随NaOH溶液体积变化的曲线如图所示.下列分析不正确的是( )| A. | a点pH<7的原因:Al3++3H2O?Al(OH)3+3H+ | |
| B. | bc段发生的主要反应:Al3++3OH-═Al(OH)3 | |
| C. | ef段发生的主要反应:Al(OH)3+OH-═AlO2-+2H2O | |
| D. | d点,溶液中大量存在的离子是Na+、AlO2-和SO42- |
20.已知常温下浓度为0.1mol/L的几种溶液的pH如表.下列有关说法正确的是( )
| 溶质 | pH |
| NaF | 7.5 |
| Na2CO3 | 11.6 |
| NaClO | 9.7 |
| NaHCO3 | 8.3 |
| A. | 同温度同浓度下,酸由强到弱的顺序为:HF>H2CO3>HClO | |
| B. | 水解方程式:F-+H2O?HF+OH-的平衡常数为1×10-13 | |
| C. | 将CO2通入0.lmol/LNa2CO3溶液至溶液呈中性,则溶液中:2c(CO32-)+c(HCO3-)=0.1mol/L | |
| D. | 等物质的量的NaF和HF混合溶液中粒子浓度大小关系为:c(HF)>c(Na+)>c(F-)>c (H+)>c(OH-) |
7.25℃时,几种物质的电离平衡常数如表:
下列叙述正确的是( )
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Ka=3.0×10-8 |
| A. | HClO的漂白性是因为酸性很弱 | |
| B. | 相同浓度的Na2CO3与NaHCO3溶液,后者的pH更大 | |
| C. | 反应 2C1O-+CO2+H2O=CO32-+2HClO可以发生 | |
| D. | 稀释醋酸溶液,则$\frac{{c(C{H_3}CO{O^-})}}{{c(C{H_3}COOH)}}$的数值随水量的增加而增大 |
4.下列叙述中正确的是( )
| A. | 寺院内铜佛像用导线与直流电源的正极连接可以防锈 | |
| B. | 家厨内铁锅洗净后未擦干易生锈主要是发生了化学腐蚀 | |
| C. | 红葡萄酒密封贮存越久越香可能是因为缓慢生成了酯类物质 | |
| D. | 液氯泄漏时,可用肥皂水浸湿的毛巾捂鼻俯卧于低处等待救援 |
15.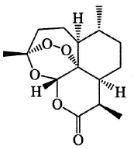 中国药学家屠呦呦因发现青蒿素及其抗疟疗效,荣获诺贝尔生理学或医学奖.青蒿素结构式如图所示,下列有关青蒿素研究的说法不正确的是( )
中国药学家屠呦呦因发现青蒿素及其抗疟疗效,荣获诺贝尔生理学或医学奖.青蒿素结构式如图所示,下列有关青蒿素研究的说法不正确的是( )
 中国药学家屠呦呦因发现青蒿素及其抗疟疗效,荣获诺贝尔生理学或医学奖.青蒿素结构式如图所示,下列有关青蒿素研究的说法不正确的是( )
中国药学家屠呦呦因发现青蒿素及其抗疟疗效,荣获诺贝尔生理学或医学奖.青蒿素结构式如图所示,下列有关青蒿素研究的说法不正确的是( )| A. | 提取过程中为防止破坏青蒿素结构,应避免高温,故采用低沸点溶剂乙醚进行萃取 | |
| B. | 可使用质谱仪测出这个分子的相对分子质量,也可用紫外光谱确定这个分子的环状结构 | |
| C. | 青蒿素是脂溶性的,既可看作是醚类也可看作是酯类,既有氧化性又有还原性 | |
| D. | 元素分析仪可以确定青蒿素中是否含有C、H、O等元素 |


 的名称2,3,5-三甲基-4-乙基庚烷
的名称2,3,5-三甲基-4-乙基庚烷 ,
,