题目内容
11.有下列五种说法:①使离子相结合或原子相结合的作用力,叫做化学键;②两个非金属原子间不可能形成离子键;③非金属原子间不可能形成离子化合物;④离子化合物中不能存在共价键;⑤某化合物的水溶液能导电,则该化合物中一定存在离子键,其中正确的是( )| A. | ①② | B. | ②③④ | C. | ②④⑤ | D. | ①②③④⑤ |
分析 ①相邻原子间的强烈的相互作用叫化学键;
②两个非金属原子间只能以共用电子对结合;
③非金属原子间可形成离子键;
④共价键可存在于单质、离子化合物、共价化合物中;
⑤部分共价化合物在水中能电离,其水溶液能导电.
解答 解:①相邻原子之间的强烈的相互作用是化学键,原子可以是带电荷的原子即离子,可以是不带电荷的原子,故正确;
②两个非金属元素原子间只能形成共价键,不可能形成离子键,故正确;
③非金属原子间可形成离子键,如铵盐为离子化合物,故错误;
④共价键可存在于单质、离子化合物、共价化合物中,如离子化合物NaOH中含O-H共价键,故错误;
⑤部分共价化合物在水中能电离,其水溶液能导电,如HCl在溶液中完全电离出氯离子和氢离子,HCl的溶液能导电,HCl是共价化合物,故错误;
故选A.
点评 本题考查离子键,为高频考点,把握化学键的形成及判断的一般规律为解答的关键,侧重分析与应用能力的考查,注意结合常见的实例解答,题目难度不大.

练习册系列答案
相关题目
1.下列有关反应的离子方程式书写正确的是( )
| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | NH4HCO3溶液和足量氢氧化钠溶液反应:NH4++OH-═NH3•H2O | |
| C. | 向FeBr2溶液中通入少量氯气:Fe2++Cl2═Fe3++2Cl- | |
| D. | 氯气与Na2SO3溶液反应:Cl2+SO32-+H2O═SO42-+2Cl-+2H+ |
6.下列关于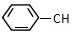 =CHCH3的说法不正确的是( )
=CHCH3的说法不正确的是( )
 =CHCH3的说法不正确的是( )
=CHCH3的说法不正确的是( )| A. | 分子式为C9H10 | B. | 该有机物的一氯代物有5种 | ||
| C. | 能使酸性高锰酸钾溶液褪色 | D. | 所有碳原子不可能在同一平面上 |
16.按要求填写下列空白:
(1)将10molA 和smolB 充入SL 密闭容器中,某温度下发生反应:3A+B?2C ( A、B、C均为气体),在最初2s内,v(A)为0.6mol/(L•s).则在2s时,B的物质的量浓度为0.6mol/L,C 的体积分数为$\frac{0.8S}{10-S}$×100%(小数点后保留一位).
(2)某同学为了探究锌与盐酸反应过程中的速率变化,他在100mL1.0mol/L盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气(气体体积已折算为标准状况),实验记录如表(累计值)
①哪一时间段(0-1min、1-2min、2-3min、3-4min、4-5min)反应速率最慢4~5min,原因是因为4~5min时H+浓度小(或酸的浓度小).
②求2-3min时间段内以盐酸的浓度变化表示的该反应的反应速率0.1mol/(L•min)(忽略溶液体积的变化).
③为了减缓反应速率而又不减少产生氢气的量,该同学在盐酸中分别加入等体积的下列}溶液:
A.蒸馏水 B.NaCl溶液 C.0.5mol/L盐酸
你认为可行的是(填序号)ABC.
(1)将10molA 和smolB 充入SL 密闭容器中,某温度下发生反应:3A+B?2C ( A、B、C均为气体),在最初2s内,v(A)为0.6mol/(L•s).则在2s时,B的物质的量浓度为0.6mol/L,C 的体积分数为$\frac{0.8S}{10-S}$×100%(小数点后保留一位).
(2)某同学为了探究锌与盐酸反应过程中的速率变化,他在100mL1.0mol/L盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气(气体体积已折算为标准状况),实验记录如表(累计值)
| 时间/min | 1 | 2 | 3 | 4 | 5 |
| 氢气体积/mL | 50 | 120 | 232 | 290 | 310 |
②求2-3min时间段内以盐酸的浓度变化表示的该反应的反应速率0.1mol/(L•min)(忽略溶液体积的变化).
③为了减缓反应速率而又不减少产生氢气的量,该同学在盐酸中分别加入等体积的下列}溶液:
A.蒸馏水 B.NaCl溶液 C.0.5mol/L盐酸
你认为可行的是(填序号)ABC.
3.下列转化中,碳原子间的连接形式未发生改变的是( )
| A. | 丁酮的催化加氢反应 | B. | 丙酮与HCN发生加成反应 | ||
| C. | 乙醛与乙醛反应生成2-羟基丁醛 | D. | 乙苯与酸性高锰酸钾溶液反应 |
20.已知常温下浓度为0.1mol/L的几种溶液的pH如表.下列有关说法正确的是( )
| 溶质 | pH |
| NaF | 7.5 |
| Na2CO3 | 11.6 |
| NaClO | 9.7 |
| NaHCO3 | 8.3 |
| A. | 同温度同浓度下,酸由强到弱的顺序为:HF>H2CO3>HClO | |
| B. | 水解方程式:F-+H2O?HF+OH-的平衡常数为1×10-13 | |
| C. | 将CO2通入0.lmol/LNa2CO3溶液至溶液呈中性,则溶液中:2c(CO32-)+c(HCO3-)=0.1mol/L | |
| D. | 等物质的量的NaF和HF混合溶液中粒子浓度大小关系为:c(HF)>c(Na+)>c(F-)>c (H+)>c(OH-) |
11. (1)用“=”、“>”、“<”填写下表
(1)用“=”、“>”、“<”填写下表
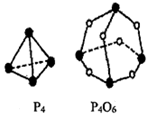
(2)白磷(P4)和P4O6的分子结构如图,现提供以下化学键的键能:P-P为E1 kJ•mol-1、P-O为E2 kJ•mol-1、O=O为E3 kJ•mol-1,则:
P4(s)+3O2(g)═P4O6(s)的反应热△H=(6E1+3E3-12E2)kJ•mol-1(用E1、E2、E3表示)
 (1)用“=”、“>”、“<”填写下表
(1)用“=”、“>”、“<”填写下表 | 第一电离能 | 电负性 | 晶格能 | 沸点 |
| O <N | Cl <F | NaCl >KBr | HF >HCl |
P4(s)+3O2(g)═P4O6(s)的反应热△H=(6E1+3E3-12E2)kJ•mol-1(用E1、E2、E3表示)
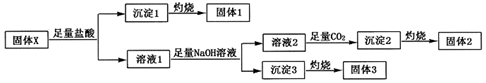
 ,沉淀2的化学式为Al(OH)3.
,沉淀2的化学式为Al(OH)3.


