题目内容
10.实验室用燃烧法按如图装置测定某氨基酸(CxHyOzNm)的分子组成.实验时,取W g该种氨基酸放在纯氧中充分燃烧,生成二氧化碳、水和氮气.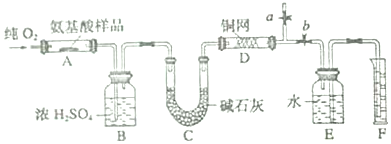
(1)实验开始时,首先通入一段时间的氧气,其理由是将装置中的N2排净.
(2)以上装置中A、D均需要加热,操作时应先点燃D处的酒精灯.
(3)D装置的作用是吸收未反应的氧气,保证最终收集的是N2.
分析 该实验原理为:Wg该种氨基酸放在纯氧中充分燃烧,生成CO2、H2O和N2.装置B内盛放浓硫酸,吸收生成的水,根据装置B增重,确定Wg该种氨基酸中含氢元素质量,根据F中水的体积确定氮气的体积,并由此确定待测氨基酸中含有的氮元素的质量,再计算氧元素的质量,确定分子中元素原子个数比,由此确定最简式,
(1)空气中的氮气会产生干扰,需要用氧气除去;
(2)剩余氧气影响氮气的测量,需要先点燃D处酒精灯保证除掉氧气;
(3)未反应的氧气影响氮气的侧链,需要利用铜网吸收未反应的O2.
解答 解:(1)空气中的氮气会产生干扰,首先要通入一段时间的氧气,将装置中的N2排净,
故答案为:将装置中的N2排净;
(2)氨基酸和氧气的反应,以及铜网和氧气的反应都需要加热,应先点燃D处的酒精灯,吸收未反应的氧气,保证最终收集的气体为N2,
故答案为:D;
(3)根据以上分析可知,铜网的作用是吸收未反应的O2,保证最终收集到的气体是反应生成的N2,
故答案为:吸收未反应的氧气,保证最终收集的是N2.
点评 本题考查学生利用燃烧法确定有机物分子组成的知识,为高频考点,侧重于学生的分析、实验和计算能力的考查,注意根据原子守恒法来解答,难度不大,关键在于理解实验原理.

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目
9.表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素原子的核电荷数为Y元素的2倍.下列说法正确的是( )
| X | Y | ||
| Z | W | ||
| T |
| A. | 元素X、W、Z在自然界中均可以游离态存在 | |
| B. | 元素X、Y、W的原子半径依次递增 | |
| C. | 实验室储存T的单质时,应在其表面覆盖少量的水 | |
| D. | 元素Z的氧化物是制作计算机芯片的材料 |
1.下列有关反应的离子方程式书写正确的是( )
| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | NH4HCO3溶液和足量氢氧化钠溶液反应:NH4++OH-═NH3•H2O | |
| C. | 向FeBr2溶液中通入少量氯气:Fe2++Cl2═Fe3++2Cl- | |
| D. | 氯气与Na2SO3溶液反应:Cl2+SO32-+H2O═SO42-+2Cl-+2H+ |
18.下列叙述正确的是( )
| A. | 所有卤代烃都难溶于水,且都是密度比水大的液体 | |
| B. | 所有卤代烃都是通过取代反应制得 | |
| C. | 卤代烃可用作制冷剂、灭火剂 | |
| D. | 卤代烃都是良好的有机溶剂 |
15.下列物质的沸点按由高到低顺序排列正确的是( )
①丙三醇
②丁烷
③乙二醇
④乙醇.
①丙三醇
②丁烷
③乙二醇
④乙醇.
| A. | ①②③④ | B. | ④③②① | C. | ②①③④ | D. | ①③④② |
20.已知常温下浓度为0.1mol/L的几种溶液的pH如表.下列有关说法正确的是( )
| 溶质 | pH |
| NaF | 7.5 |
| Na2CO3 | 11.6 |
| NaClO | 9.7 |
| NaHCO3 | 8.3 |
| A. | 同温度同浓度下,酸由强到弱的顺序为:HF>H2CO3>HClO | |
| B. | 水解方程式:F-+H2O?HF+OH-的平衡常数为1×10-13 | |
| C. | 将CO2通入0.lmol/LNa2CO3溶液至溶液呈中性,则溶液中:2c(CO32-)+c(HCO3-)=0.1mol/L | |
| D. | 等物质的量的NaF和HF混合溶液中粒子浓度大小关系为:c(HF)>c(Na+)>c(F-)>c (H+)>c(OH-) |


 的名称2,3,5-三甲基-4-乙基庚烷
的名称2,3,5-三甲基-4-乙基庚烷 ,
,
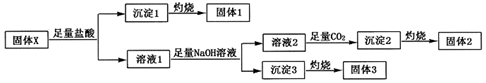
 ,沉淀2的化学式为Al(OH)3.
,沉淀2的化学式为Al(OH)3.


