题目内容
15.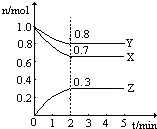 某温度时,在一个2L恒容的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个2L恒容的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:(1)该反应的化学方程式为3X+2Y?3Z.
(2)从开始至2min,Z的平均反应速率为0.075mol•L-1•min-1.
(3)2min时X的转化率为30%.
分析 (1)根据物质的量的变化判断反应物和生成物,根据物质的量的变化之比等于化学计量数之比书写方程式;
(2)分析图象计算Z的消耗物质的量为0.2mol,结合反应速率概念计算,V=$\frac{△c}{△t}$;
(3)2min时X的转化率=$\frac{消耗量}{起始量}$×100%;
解答 解:(1)由图象可以看出,反应中X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,且△n(X):△n(Y):△n(Z)=(1mol-0.7mol):(1mol-0.8mol):0.3=0.3mol:0.2mol:0.3mol=3:2:3,则反应的化学方程式为:3X+2Y?3Z,
故答案为:3X+2Y?3Z;
(2)图象计算Z的生成物质的量为0.3mol,从开始至2min,Z的平均反应速率=$\frac{\frac{0.3mol}{2L}}{2min}$=0.075mol/(L•min);
故答案为:0.075;
(3)2min时X的转化率=$\frac{消耗量}{起始量}$×100%=$\frac{1.0mol-0.7mol}{1.0mol}$×100%=30%,
故答案为:30%;
点评 本题考查了化学反应速率的计算应用等,图象分析和反应进行方向的判断方法是解题关键,题目较简单.

练习册系列答案
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案
相关题目
3.下列粒子半径之比小于1的是( )
| A. | $\frac{r(Na)}{r(N{a}^{+})}$ | B. | $\frac{r({F}^{-})}{r({O}^{2-})}$ | C. | $\frac{r(Na)}{r(Mg)}$ | D. | $\frac{r(Ca)}{r(Mg)}$ |
10.煤在燃烧时会产生SO2,造成环境污染.下列说法正确的有( )
| A. | SO2是形成酸雨的主要气体 | |
| B. | 用碱液吸收燃煤废气可减少环境污染 | |
| C. | 往燃煤中混入生石灰,可减少SO2排放 | |
| D. | 用水溶解、过滤除去煤中的单质硫以减少SO2排放 |
20.下列物质发生变化时,所克服的微粒间的相互作用属于同种类型的是( )
| A. | 氢氧化钠和葡萄糖分别溶解在水中 | B. | 干冰和氯化铵分别受热变为气体 | ||
| C. | 食盐和冰分别受热熔化 | D. | 液溴和酒精分别挥发 |
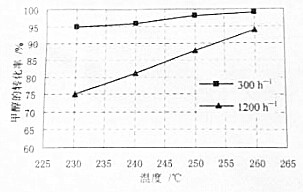 以高纯H2燃料的质子交换膜燃料电池具有能量效率高、无污染等优点,但燃料中若混有CO将显著缩短电池寿命.以甲醇为原料制取高纯H2是重要研究方向.
以高纯H2燃料的质子交换膜燃料电池具有能量效率高、无污染等优点,但燃料中若混有CO将显著缩短电池寿命.以甲醇为原料制取高纯H2是重要研究方向. 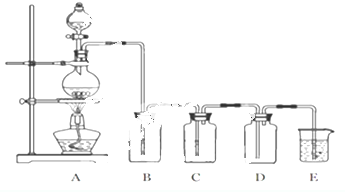
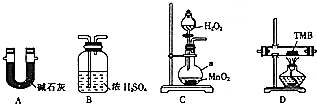 由碳、氢、氮三种元素组成的TMB是一种新型指纹检测的色原试剂,其相对分子质量为240.某研究性学习小组的同学欲利用下列装置测定TMB的分子式.实验原理:在足量氧气流中将4.80gTMB样品氧化(氮元素转化为N2),再利用吸收剂分别吸收水蒸气和CO2.请从图中选择适当的装置(部分装置可以重复)进行实验.
由碳、氢、氮三种元素组成的TMB是一种新型指纹检测的色原试剂,其相对分子质量为240.某研究性学习小组的同学欲利用下列装置测定TMB的分子式.实验原理:在足量氧气流中将4.80gTMB样品氧化(氮元素转化为N2),再利用吸收剂分别吸收水蒸气和CO2.请从图中选择适当的装置(部分装置可以重复)进行实验. .
. .
.