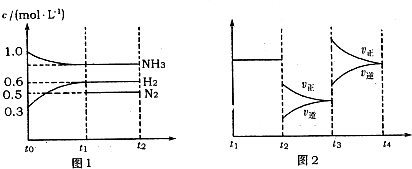
题目内容
5.有A、B、C、D、E 5种元素,它们的核电荷数依次增大,且都小于20.其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1.B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半.请回答下列问题:(1)A是H,B是O,C是Al,D是S,E是K.
(2)B、C、D、E四种元素的简单离子按半径由小到大的顺序为(用离子符号表示)Al3+<O2-<K+<S2-.
(3)元素B与D的电负性的大小关系是O>S,C与E的第一电离能的大小关系是Al>K.(填>、<、﹦,用元素符号表示)
(4)用轨道表示式表示D元素原子的价电子排布3s23p4.
(5)写出A和B按原子个数比1:1形成的化合物的电子式
 .
.(6)用电子式表示D和E形成离子化合物的形成过程
 .
.
分析 A、B、C、D、E 5种短周期元素,它们的核电荷数依次增大,且都小于20,B和D属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,最外层电子排布为ns2np4,则B为O元素、D为S元素;A和E属同一族,它们原子的最外层电子排布为ns1,处于IA族,E的原子序数大于硫,且5种元素中只有C、E是金属元素,则A为H元素、E为K元素;C原子最外层上电子数等于D原子最外层上电子数的一半,其最外层电子数为6×$\frac{1}{2}$=3,故C为Al,结合题目分析解答.
解答 解:A、B、C、D、E 5种短周期元素,它们的核电荷数依次增大,且都小于20,B和D属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,最外层电子排布为ns2np4,则B为O元素、D为S元素;A和E属同一族,它们原子的最外层电子排布为ns1,处于IA族,E的原子序数大于硫,且5种元素中只有C、E是金属元素,则A为H元素、E为K元素;C原子最外层上电子数等于D原子最外层上电子数的一半,其最外层电子数为6×$\frac{1}{2}$=3,故C为Al,
(1)通过以上分析知,A、B、C、D、E分别是H、O、Al、S、K元素,
故答案为:H;O;Al;S;K;
(2)电子层结构相同的离子,离子半径随着原子序数增大而减小,电子层数越多其离子半径越大,所以离子半径从小到大顺序是Al3+<O2-<K+<S2-,故答案为:Al3+<O2-<K+<S2-;
(3)B是O、D是S元素,同一主族元素,元素的电负性随着原子序数增大而减小,所以电负性O>S;元素的金属性越强,其第一电离能越小,所以第一电离能Al>K,
故答案为:O>S;Al>K;
(4)D是S元素,其3s、3p电子为其价电子,则S原子价电子排布式为3s23p4,故答案为:3s23p4;
(5)A和B按原子个数比1:1形成的化合物是双氧水,双氧水的电子式为 ,故答案为:
,故答案为: ;
;
(6)D是S、E是K元素,二者通过得失电子形成离子化合物,其形成过程为 ,故答案为:
,故答案为: .
.
点评 本题考查位置结构和性质的相互关系,为高频考点,涉及元素推断、电子式的书写、元素周期律等知识点,明确原子结构、物质结构、元素周期律是解本题关键,注意半径大小比较方法,易错点是电子式的书写.

| 实验操作 | 现象和结论 | |
| A | 在平衡3KSCN+FeCl3?Fe(SCN)3+3KCl的溶液中加入少量KCl溶液 | 溶液红色变浅,平衡逆向移动 |
| B | 向AgI沉淀中滴入KCl溶液 | 有白色沉生成,Ksp(AgCl)<Ksp(AgI) |
| C | 把Cl2通入品红溶液中 | 溶液褪色,Cl2具有漂白性 |
| D | 向Fe(NO3)2溶液中滴入硫酸酸化的H2O2溶液 | 溶液变为黄色,氧化性:H2O2>Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
| A. | 2,3-二甲基丁烷 | B. | 3,3-二甲基丁烷 | ||
| C. | 2-甲基-3-乙基戊烷 | D. | 2,2,3,3-四甲基丁烷 |
| A. | 氢键;分子间作用力;非极性键 | B. | 氢键;极性键;非极性键 | ||
| C. | 氢键;极性键;分子间作用力 | D. | 分子间作用力;氢键;非极性键 |
| A. | N O P | B. | Li Be Mg | C. | C N P | D. | Ar Cl F |
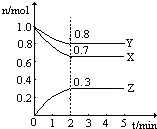 某温度时,在一个2L恒容的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个2L恒容的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白: