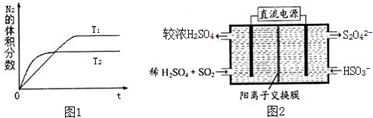
题目内容
20.下列物质发生变化时,所克服的微粒间的相互作用属于同种类型的是( )| A. | 氢氧化钠和葡萄糖分别溶解在水中 | B. | 干冰和氯化铵分别受热变为气体 | ||
| C. | 食盐和冰分别受热熔化 | D. | 液溴和酒精分别挥发 |
分析 根据晶体类型判断,相同类型的晶体,克服的相互作用力相同;离子晶体克服的是离子键,分子晶体的是分子间作用力,原子晶体克服的是共价键,金属晶体克服的是金属键,以此解答该题.
解答 解:A.氢氧化钠为离子晶体,葡萄糖为分子晶体,溶于水分别克服离子键、分子间作用力,故A错误;
B.干冰为分子晶体、氯化铵为离子晶体,加热时干冰克服分子间作用力,氯化铵分解克服离子键,故B错误;
C.食盐是离子晶体,破坏离子键,冰是分子晶体,破坏分子间作用力,故C错误;
D.液溴和酒精都是分子晶体,挥发克服分子间作用力,故D正确.
故选D.
点评 本题考查了化学键和分子间作用力,为高频考点,题目难度不大,此类题的解题方法是:先判断晶体类型,再判断微粒间的作用力.

练习册系列答案
相关题目
11.关于吸热反应的说法正确的是( )
| A. | 凡需加热的反应一定是吸热反应 | |
| B. | 相同条件下,2molH2(g)与lmolO2(g)完全化合生成2molH2O(g),放出aKJ热量,2molH2 (g)与lmolO2(g)完全化合生成2molH2O(l),放出bkJ 热量,则a>b | |
| C. | 若CO2与CaO化合是放热反应,则CaCO3分解是吸热反应 | |
| D. | 相同条件下,1molH2O(l)与1molCaO完全化合,放出a kJ热量,2molH2O(l)与2molCaO完全化合,也放出a kJ热量 |
8.生理盐水是指质量分数为0.9%的NaCl溶液.下列有关该溶液说法正确的是( )
| A. | 100g溶液中含有0.9 g NaCl | B. | 100 g水中含有0.9 g NaCl | ||
| C. | 100 g溶液中含有0.9 mol NaCl | D. | 100 g水中含有0.9 mol NaCl |
5.研究表明26Al可以衰变为26Mg,可以比较这两种元素金属性强弱的方法是( )
| A. | 比较这两种元素的单质的硬度和熔点 | |
| B. | 在氯化铝和氯化镁的溶液中分别滴加过量的氨水 | |
| C. | 将打磨过的镁带和铝片分别和热水作用,并滴入酚酞溶液 | |
| D. | 将空气中放置已久的这两种元素的单质分别和热水作用 |
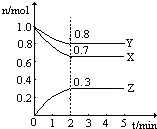 某温度时,在一个2L恒容的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个2L恒容的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白: