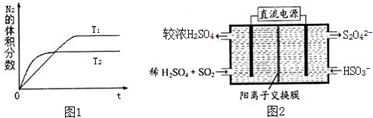
题目内容
3.下列粒子半径之比小于1的是( )| A. | $\frac{r(Na)}{r(N{a}^{+})}$ | B. | $\frac{r({F}^{-})}{r({O}^{2-})}$ | C. | $\frac{r(Na)}{r(Mg)}$ | D. | $\frac{r(Ca)}{r(Mg)}$ |
分析 A.原子半径大于相应的阳离子半径;
B.电子层结构相同的离子,核电荷数越大离子半径越小;
C.同周期自左而右原子半径减小;
D.同主族自上而下原子半径增大.
解答 解:A.原子半径大于相应的阳离子半径,故$\frac{r(Na)}{r(N{a}^{+})}$>1,故A不符合;
B.原子半径小于相应的阴离子半径,故$\frac{r({F}^{-})}{r({O}^{2-})}$<1,故B符合;
C.同周期自左而右原子半径减小,故$\frac{r(Na)}{r(Mg)}$>1,故C不符合;
D.同主族自上而下原子半径增大,故$\frac{r(Ca)}{r(Mg)}$>1,故D不符合.
故选:B.
点评 本题考查微粒半径半径,半径基础,掌握微粒半径比较规律,从结构上理解同主族、同周期原子半径变化规律.

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目
14.恒温恒容NO2(g)+SO2(g)?SO3(g)+NO(g),测得反应体系中NO2、SO2气体的体积分数Φ(NO2)、Φ(SO2)与反应时间t的关系如下表:
①下列能说明反应达到平衡状态的是b.
a.体系压强保持不变 b.混合气体颜色保持不变
c.反应的焓变保持不变 d.每消耗1mol SO3同时生成1 mol SO2
②根据上述实验结果,该温度下反应的平衡常数K的计算结果为$\frac{8}{3}$(不用小数表示).
③上述反应中,正反应速率为v正=k正Φ(NO2)Φ(SO2),逆反应速率v逆=k逆Φ(SO3)Φ(NO),其中k正、k逆为速率常数,则k正=K•k逆(以K和k逆表示)
| t/min | t0 | t1 | t2 | t3 | t4 | t5 |
| Φ(NO2) | $\frac{1}{3}$ | 0.30 | $\frac{4}{15}$ | $\frac{1}{6}$ | $\frac{1}{15}$ | $\frac{1}{15}$ |
| Φ(SO2) | $\frac{2}{3}$ | $\frac{19}{30}$ | 0.60 | 0.50 | 0.40 | 0.40 |
a.体系压强保持不变 b.混合气体颜色保持不变
c.反应的焓变保持不变 d.每消耗1mol SO3同时生成1 mol SO2
②根据上述实验结果,该温度下反应的平衡常数K的计算结果为$\frac{8}{3}$(不用小数表示).
③上述反应中,正反应速率为v正=k正Φ(NO2)Φ(SO2),逆反应速率v逆=k逆Φ(SO3)Φ(NO),其中k正、k逆为速率常数,则k正=K•k逆(以K和k逆表示)
11.关于吸热反应的说法正确的是( )
| A. | 凡需加热的反应一定是吸热反应 | |
| B. | 相同条件下,2molH2(g)与lmolO2(g)完全化合生成2molH2O(g),放出aKJ热量,2molH2 (g)与lmolO2(g)完全化合生成2molH2O(l),放出bkJ 热量,则a>b | |
| C. | 若CO2与CaO化合是放热反应,则CaCO3分解是吸热反应 | |
| D. | 相同条件下,1molH2O(l)与1molCaO完全化合,放出a kJ热量,2molH2O(l)与2molCaO完全化合,也放出a kJ热量 |
18.a、b、c、d为短周期元素,a的M电子层有1个电子,b的最外层电子数为内层电子数的2倍,c的最高化合价为最低化合价绝对值的3倍,c与d同周期,d的原子半径小于c.下列叙述错误的是( )
| A. | d元素的非金属性最强 | |
| B. | 它们均存在两种或两种以上的氧化物 | |
| C. | 只有a与题中其他元素生成的化合物都是离子化合物 | |
| D. | c、d形成的气态氢化物的还原性:d>c |
8.生理盐水是指质量分数为0.9%的NaCl溶液.下列有关该溶液说法正确的是( )
| A. | 100g溶液中含有0.9 g NaCl | B. | 100 g水中含有0.9 g NaCl | ||
| C. | 100 g溶液中含有0.9 mol NaCl | D. | 100 g水中含有0.9 mol NaCl |
13.下列有关实验操作、现象和结论都正确的是( )
| 实验操作 | 现象和结论 | |
| A | 在平衡3KSCN+FeCl3?Fe(SCN)3+3KCl的溶液中加入少量KCl溶液 | 溶液红色变浅,平衡逆向移动 |
| B | 向AgI沉淀中滴入KCl溶液 | 有白色沉生成,Ksp(AgCl)<Ksp(AgI) |
| C | 把Cl2通入品红溶液中 | 溶液褪色,Cl2具有漂白性 |
| D | 向Fe(NO3)2溶液中滴入硫酸酸化的H2O2溶液 | 溶液变为黄色,氧化性:H2O2>Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
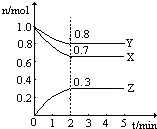 某温度时,在一个2L恒容的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
某温度时,在一个2L恒容的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白: