题目内容
一个电池反应的离子方程式是 Zn+Cu2+═Zn2++Cu,该反应的原电池正确组合是( )
| A | B | C | D | |
| 正极 | Zn | Cu | Cu | Fe |
| 负极 | Cu | Zn | Zn | Zn |
| 电解质溶液 | CuCl2 | H2SO4 | CuSO4 | HCl |
| A、A | B、B | C、C | D、D |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:由电池反应式Zn+Cu2+═Zn2++Cu知,锌失电子发生氧化反应,作负极;不如锌活泼的金属或导电的非金属作正极,正极上铜离子得电子发生还原反应,电解质溶液中应含有铜离子,所以应为铜盐.
解答:
解:由电池反应式Zn+Cu2+═Zn2++Cu知,锌失电子发生氧化反应,失电子的物质的负极上发生氧化反应,所以锌作负极;
不如锌活泼的金属或导电的非金属作正极,可用铜作正极;
正极上铜离子得电子发生还原反应,所以电解质溶液中应含有铜离子,可用含有铜离子的盐溶液作电解质溶液,故选C.
不如锌活泼的金属或导电的非金属作正极,可用铜作正极;
正极上铜离子得电子发生还原反应,所以电解质溶液中应含有铜离子,可用含有铜离子的盐溶液作电解质溶液,故选C.
点评:本题考查了原电池原理,难度不大,注意根据方程式中发生的反应类型判断原电池的正负极.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
下列离子在溶液中能大量共存的是( )
| A、Mg2+、H+、SO42-、Cl- |
| B、Ca2+、H+、NO3-、CO32- |
| C、Fe3+、Na+、SCN-、OH- |
| D、Cu2+、NH4+、Cl-、OH- |
在通常条件下,下列各组物质的性质排列正确的是( )
| A、熔点:CO2>KCl>SiO2 |
| B、结合质子能力:Cl->CH3COO->OH- |
| C、沸点:乙烷>戊烷>丁烷 |
| D、热稳定性:HF>H2O>NH3 |
下列气态氢化物中,最不稳定的是( )
| A、HI | B、HBr |
| C、HCl | D、HF |
下列表达式错误的是( )
A、甲烷的电子式: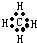 |
B、氮原子的L层电子轨道表示式: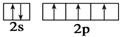 |
| C、硫离子的核外电子排布式:1s22s22p63s23p4 |
| D、碳原子最外层电子排布:2s22p2 |
下列说法中,正确的是( )
| A、CO2的摩尔质量为44g |
| B、标准状况下,1molCO2所占的体积约是22.4L |
| C、1molN2的质量是14g |
| D、将40gNaOH溶于1L水中,所得溶液中NaOH的物质的量浓度为1mol/L |
设NA为阿佛加德罗常数,下列说法不正确的是( )
| A、78gNa2O2固体中含有的阴离子数为NA(相对原子质量 Na:23 O:16 H:1) |
| B、标准状况下,11.2L乙烯含有的共价键数目为3 NA |
| C、在0℃,101千帕时,金属钠从水中置换出22.4LH2,发生转移的电子数为2NA |
| D、在25℃,pH=13的NaOH溶液中含有的OH-数约为6.02×1022 |
 某校化学兴趣小组对一款锌铁合金中铁的含量进行测定,该小组提出用测定产生氢气的体积的方法来进行实验.实验过程中需要读取氢气体积.
某校化学兴趣小组对一款锌铁合金中铁的含量进行测定,该小组提出用测定产生氢气的体积的方法来进行实验.实验过程中需要读取氢气体积.