题目内容
 二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂,ClO2是一种黄绿色的有毒气体,易溶于水.
二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂,ClO2是一种黄绿色的有毒气体,易溶于水.(1)ClO2的制备方法很多,我国科学家经过不断探索,提出将经干燥空气稀释的氯气通入填充有固体亚氯酸钠(NaClO2)的反应柱内制得ClO2的方法.该反应中,NaClO2作
(2)ClO2可将废水中的Mn2+转化为MnO2而除去,本身还原为Cl-,该反应过程中氧化剂与还原剂的物质的量之比为
(3)ClO2遇浓盐酸会生成Cl2,每生成1molCl2移电子的物质的量为
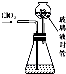
(4)测定ClO2 含量的过程如下:如图在锥形瓶中加入足量的碘化钾,用100mL水溶解后,再加入3mL硫酸;在玻璃液封管中加入水;将生成的ClO2气体通过导管在锥形瓶中被吸收;将玻璃液封管中的水封液倒入锥形瓶中,加入几滴淀粉溶液,用c mol?L-1的硫代硫酸钠标准溶液滴定(I2+2S2
| O | 2- 3 |
| O | 2- 3 |
①ClO2通入锥形瓶与酸性碘化钾溶液反应的离子方程式为
②装置中玻璃封管的作用是
③测得ClO2的质量m(ClO2)=
考点:探究物质的组成或测量物质的含量,氧化还原反应,氯、溴、碘及其化合物的综合应用
专题:实验探究和数据处理题
分析:(1)反应中亚氯酸钠(NaClO2)的反应柱内制得ClO2,依据氯元素不包含分析,元素化合价升高做还原剂被氧化;
(2)ClO2可将废水中的Mn2+转化为MnO2而除去,本身还原为Cl-,结合氧化还原反应电子守恒计算氧化剂和还原剂物质的量之比;
(3)ClO2遇浓盐酸会生成Cl2,书写离子方程式,结合氧化还原反应电子守恒计算;
(4)①由题目信息可知,ClO2通入锥形瓶与酸性碘化钾溶液反应,氧化I-为I2,自身被还原为Cl-,同时生成水.
②用水再次吸收残余的二氧化氯气体,并使锥形瓶内外压强相等.
③根据关系式2ClO2~5I2~10Na2S2O3计算n(ClO2),再根据m=nM计算m(ClO2).
(2)ClO2可将废水中的Mn2+转化为MnO2而除去,本身还原为Cl-,结合氧化还原反应电子守恒计算氧化剂和还原剂物质的量之比;
(3)ClO2遇浓盐酸会生成Cl2,书写离子方程式,结合氧化还原反应电子守恒计算;
(4)①由题目信息可知,ClO2通入锥形瓶与酸性碘化钾溶液反应,氧化I-为I2,自身被还原为Cl-,同时生成水.
②用水再次吸收残余的二氧化氯气体,并使锥形瓶内外压强相等.
③根据关系式2ClO2~5I2~10Na2S2O3计算n(ClO2),再根据m=nM计算m(ClO2).
解答:
解:(1)固体亚氯酸钠(NaClO2)的反应柱内制得ClO2的方法.该反应中氯元素化合价+3价变化为+4价,元素化合价升高失电子,NaClO2作还原剂;
故答案为:还原剂;
(2)ClO2可将废水中的Mn2+转化为MnO2而除去,本身还原为Cl-,反应中ClO2为氧化剂,Cl元素化合价由+4价降低为-1价,Mn2+为还原剂,元素化合价由+2价升高到+4价,氧化剂和还原剂得失电子数目相等,则氧化剂和还原剂的物质的量之比为2:5,
故答案为:2:5;
(3)ClO2遇浓盐酸会生成Cl2,同时生成水,反应的化学方程式为2ClO2+8HCl=5Cl2+4H2O,由方程式可知,当生成5molCl2,转移8mol电子,则生成1mol Cl2转移电子的物质的量为1.6mol,
故答案为:1.6mol;
(4)①由题目信息可知,ClO2通入锥形瓶与酸性碘化钾溶液反应,氧化I-为I2,自身被还原为Cl-,同时生成水,反应离子方程式为2ClO2+10I-+8H+=2Cl-+5I2+4H2O.
故答案为:2ClO2+10I-+8H+=2Cl-+5I2+4H2O.
②装置中玻璃液封管的作用是,用水再次吸收残余的二氧化氯气体,并使锥形瓶内外压强相等.
故答案为:用水再次吸收残余的二氧化氯气体,并使锥形瓶内外压强相等.
③VmLNa2S2O3溶液含有Na2S2O3物质的量为V?10-3 L×cmol/L=c?V?10-3 mol.则:
根据关系式:2ClO2~5I2~10Na2S2O3,
2 10
n(ClO2) c?V?10-3 mol
所以n(ClO2)=
c?V?10-3 mol.
所以m(ClO2)=
c?V?10-3 mol×67.5g/mol=1.35cv×10-2g.
故答案为:1.35cv×10-2g.
故答案为:还原剂;
(2)ClO2可将废水中的Mn2+转化为MnO2而除去,本身还原为Cl-,反应中ClO2为氧化剂,Cl元素化合价由+4价降低为-1价,Mn2+为还原剂,元素化合价由+2价升高到+4价,氧化剂和还原剂得失电子数目相等,则氧化剂和还原剂的物质的量之比为2:5,
故答案为:2:5;
(3)ClO2遇浓盐酸会生成Cl2,同时生成水,反应的化学方程式为2ClO2+8HCl=5Cl2+4H2O,由方程式可知,当生成5molCl2,转移8mol电子,则生成1mol Cl2转移电子的物质的量为1.6mol,
故答案为:1.6mol;
(4)①由题目信息可知,ClO2通入锥形瓶与酸性碘化钾溶液反应,氧化I-为I2,自身被还原为Cl-,同时生成水,反应离子方程式为2ClO2+10I-+8H+=2Cl-+5I2+4H2O.
故答案为:2ClO2+10I-+8H+=2Cl-+5I2+4H2O.
②装置中玻璃液封管的作用是,用水再次吸收残余的二氧化氯气体,并使锥形瓶内外压强相等.
故答案为:用水再次吸收残余的二氧化氯气体,并使锥形瓶内外压强相等.
③VmLNa2S2O3溶液含有Na2S2O3物质的量为V?10-3 L×cmol/L=c?V?10-3 mol.则:
根据关系式:2ClO2~5I2~10Na2S2O3,
2 10
n(ClO2) c?V?10-3 mol
所以n(ClO2)=
| 1 |
| 5 |
所以m(ClO2)=
| 1 |
| 5 |
故答案为:1.35cv×10-2g.
点评:本题考查阅读题目获取信息能力、氧化还原反应滴定及应用、离子检验、对工艺流程及装置理解分析等,难度中等,要求学生要有扎实的实验基础知识和灵活应用信息解决问题的能力.注意基础知识的全面掌握.

练习册系列答案
相关题目
下列表达式错误的是( )
A、甲烷的电子式: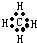 |
B、氮原子的L层电子轨道表示式: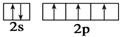 |
| C、硫离子的核外电子排布式:1s22s22p63s23p4 |
| D、碳原子最外层电子排布:2s22p2 |
下列物质分类正确的是( )
| A、SO2、SiO2、NO均为酸性氧化物 |
| B、稀豆浆、牛奶、氯化铁溶液均为胶体 |
| C、烧碱、乙醇、四氯化碳均为电解质 |
| D、福尔马林、水玻璃、氨水均为混合物 |
有机化学中取代反应范畴很广,下列3个反应中,属于取代反应范畴的是(填写相应的字母) ( )
A、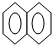 +HNO3 +HNO3
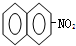 +H2O +H2O | |||
B、
| |||
C、2CH3CH2OH
|

 某校化学兴趣小组对一款锌铁合金中铁的含量进行测定,该小组提出用测定产生氢气的体积的方法来进行实验.实验过程中需要读取氢气体积.
某校化学兴趣小组对一款锌铁合金中铁的含量进行测定,该小组提出用测定产生氢气的体积的方法来进行实验.实验过程中需要读取氢气体积. 某学习小组利用中和反应原理和DIS系统测定某氨水的物质的量浓度,以测量溶液导电能力来判断滴定终点.实验步骤如下:
某学习小组利用中和反应原理和DIS系统测定某氨水的物质的量浓度,以测量溶液导电能力来判断滴定终点.实验步骤如下: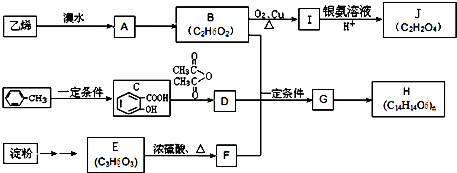 6
6