题目内容
16.已知C(s)+O2(g)=CO2(g)△H1=-393.5kJ/mol,2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ/mol,
C(s)+0.5O2(g)=CO(g)△H3=akJ/mol,则a=-110.5.
分析 已知①C(s)+O2(g)═CO2(g)△H1=-393.5kJ/mol、②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ/mol,依据盖斯定律①-$\frac{1}{2}$②可得目标反应C(s)+0.5O2(g)=CO(g,据此计算出a即可.
解答 解:已知:①C(s)+O2(g)═CO2(g)△H1=-393.5kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ/mol,
根据盖斯定律,①-$\frac{1}{2}$②可得热化学方程式为:C(s)+$\frac{1}{2}$O2(g)=CO (g)△H3=-110.5kJ/mol,则a=-110.5,
故答案为:-110.5.
点评 本题考查了盖斯定律的内容及应用方法,题目难度不大,根据盖斯定律得出已知反应与目标反应的关系为解答关键,注意掌握盖斯定律的内容及应用方法,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
20.某反应2C(g)?A(g)+2B(g)△H<0,下列判断正确的是( )
| A. | 任何温度下反应均难以自发进行 | B. | 任何温度下反应均可以自发进行 | ||
| C. | 仅常温下反应可以自发进行 | D. | 仅高温下反应可以自发进行 |
7.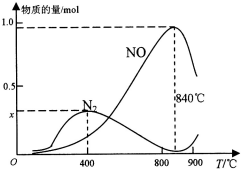 氨催化氧化是硝酸工业的基础,按要求回答下列问题:
氨催化氧化是硝酸工业的基础,按要求回答下列问题:
(1)NH3与O2可生成NO,其热化学方程式可表示为:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H
已知几种化学键的键能如表:
①由此计算得出△H=12x+5n-4y-12m (用上表中字母表示)kJ•mol-1.
②400℃时,在1L的密闭容器中加入l mol NH3和1.5mol O2,测得平衡时容器的压强为p,且比反应前压强增大了4%,则该温度下NH3的转化率为40%;该反应的平衡常数Kp=3.545×10-3p(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数);达到平衡后,保持温度不变,将反应容器的体积增大一倍,平衡向正反应(填“正反应”或“逆反应”)方向移动,判断理由是对气体分子数增大的反应,减小压强平衡向正反应方程移动.
(2)实际反应中,在上述1L的密闭容器中加入l mol NH3和1.5mol O2的反应过程中还发生4NH3+3O2?N2+6H2O反应,有关温度与各物质的量关系如图所示:
①已知400℃时,混合气体中NH3、N2、NO的物质的量比为5:6:3,则图象中x=0.3.
②NH3生成NO和N2的反应分别属于放热反应、放热反应(填“吸热反应”或“放热反应”),温度高于840℃后,各物质的物质的量发生如图所示变化的原因可能是可能是氨气高温分解生成氮气和氢气,使氨气氧化生成NO平衡向左移动;NO高温分解生成氮气和氧气;氨气和NO反应生成氮气和水(只答一条即可).
 氨催化氧化是硝酸工业的基础,按要求回答下列问题:
氨催化氧化是硝酸工业的基础,按要求回答下列问题:(1)NH3与O2可生成NO,其热化学方程式可表示为:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H
已知几种化学键的键能如表:
| 化学键 | N-H |  | O-H | O=O |
| E/(kJ•mol-1) | x | y | m | n |
②400℃时,在1L的密闭容器中加入l mol NH3和1.5mol O2,测得平衡时容器的压强为p,且比反应前压强增大了4%,则该温度下NH3的转化率为40%;该反应的平衡常数Kp=3.545×10-3p(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数);达到平衡后,保持温度不变,将反应容器的体积增大一倍,平衡向正反应(填“正反应”或“逆反应”)方向移动,判断理由是对气体分子数增大的反应,减小压强平衡向正反应方程移动.
(2)实际反应中,在上述1L的密闭容器中加入l mol NH3和1.5mol O2的反应过程中还发生4NH3+3O2?N2+6H2O反应,有关温度与各物质的量关系如图所示:
①已知400℃时,混合气体中NH3、N2、NO的物质的量比为5:6:3,则图象中x=0.3.
②NH3生成NO和N2的反应分别属于放热反应、放热反应(填“吸热反应”或“放热反应”),温度高于840℃后,各物质的物质的量发生如图所示变化的原因可能是可能是氨气高温分解生成氮气和氢气,使氨气氧化生成NO平衡向左移动;NO高温分解生成氮气和氧气;氨气和NO反应生成氮气和水(只答一条即可).
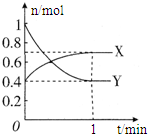
1.温度为T时,在4.0L恒容密闭容器中充入2.0mol PCl5,发生反应:PCl5(g)?PCl3(g)+Cl2(g),反应时间(t)与容器内气体总压强(p)的数据见表:
(1)由总压强p和起始压强p0计算反应物PCl5的转化率α(PCl5)的表达式为?平衡时PCl5的转化率为多少?
(2)反应在前50s的平均速率v(PCl3)为多少?
(3)该温度下的平衡常数为多少?
| t/s | 0 | 50 | 150 | 250 | 350 |
| 总压强p/100kPa | 100 | 116 | 119 | 120 | 120 |
(2)反应在前50s的平均速率v(PCl3)为多少?
(3)该温度下的平衡常数为多少?
8.下列实验能成功的是( )
| A. | 用 1体积的乙醇与 3体积的浓 H2SO4混合加热到 140℃制乙烯 | |
| B. | 加入适量浓溴水除去苯中混有的少量苯酚 | |
| C. | 用饱和食盐水和电石(CaC2)制乙炔 | |
| D. | 以盐酸、石灰石、苯酚钠溶液为试剂,验证酸性强弱关系:盐酸>石炭酸>碳酸 |
5.下列对气体或溶液中的离子鉴定方案正确的是( )
| A. | 向溶液中加入硫酸酸化的NaCl溶液,生成白色沉淀,证明原溶液中含Ag+ | |
| B. | 向溶液中加入稀盐酸,生成使澄清石灰水变浑浊的无色无味气体,则原溶液中含CO32- | |
| C. | 向溶液中加入硝酸酸化的BaCl2溶液,生成白色沉淀,证明原溶液中含SO42- | |
| D. | 溶液中加入HCl酸化后,再加入BaCl2溶液,有白色沉淀产生,则溶液中含有SO42- |
 在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:
在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应: ,它的共价键属于极性(填“极性”或“非极性”)键;含有离子键和非极性共价键的化合物的电子式为
,它的共价键属于极性(填“极性”或“非极性”)键;含有离子键和非极性共价键的化合物的电子式为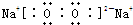 ;含有极性共价键和非极性共价键的化合物的电子式为
;含有极性共价键和非极性共价键的化合物的电子式为 .
. .
.