题目内容
4.已知MOH为一元弱碱,25℃时,电离常数Kb=1×10-6mol•L -1,(1)25℃时,将0.2mol•L-1 HCl溶液与0.2mol•L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,此时混合溶液中由水电离出的c(H+)=Amol•L-1,若0.2mol/L HCl溶液中由水电离出的c(H+)=Bmol•L-1,则:
①比较A>B.(填“>”、“<”或“=”)
②混合溶液中c(Cl-)-c(M+)=9.9×10-7mol•L -1(精确计算,填具体数字)
(2)25℃时,0.01mol•L -1MOH溶液的 pH=10,将其与等体积 pH=4的盐酸溶液混合,则混合溶液的pH> 7(填“>”、“<”或“=”),此时溶液中M Cl的水解平衡常数Kh=10-8
(3)某化学兴趣小组在隔绝空气的环境中,用酸性KMnO4溶液去测定FeSO4溶液的浓度(已知:5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O).
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、钥匙、玻璃棒、烧杯、量筒、胶头滴管外,还需250mL容量瓶(填写仪器名称).
②滴定实验要用到酸式滴定管或碱式滴定管,在滴定前,装标准液的滴定管要用标准液进行润洗,其操作方法是彺滴定管中加入3到5ml 润洗液,将滴定管倾斜,使略有角度,旋转360度,将润洗液倒掉,重复3次.
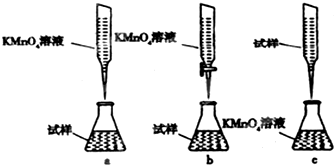
③某同学设计的下列滴定方式中,最合理的是b(夹持部分略去,填字母序号)
分析 (1)①室温下取0.2mol•L-1HCl溶液与0.2mol•L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,说明得到的盐是强酸弱碱盐,其溶液呈酸性,含有弱根离子的盐促进水电离;
②根据物料守恒和电荷守恒计算离子浓度大小;
(2)MOH为弱电解质,二者混合后碱过量,溶液显示碱性;根据MCl的水解方程式M++H2O?MOH+H+写出水解平衡常数表达式,再根据水的离子积及MOH的电离常数计算出Kh;
(3)①精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器有天平、药匙、玻棒、烧杯、胶头滴管、250mL容量瓶;
②润洗时应尽量将待装液润洗整个滴定管,可边倾斜边转动;
③酸性溶液或强氧化性溶液应用酸式滴定管.
解答 解:(1)①等体积等浓度的盐酸和MOH恰好反应生成盐,得到的盐溶液呈酸性,说明该盐是强酸弱碱盐,含有弱根离子的盐促进水电离,酸抑制水电离,所以混合溶液中水电离出的c(H+)>0.2 mol•L-1 HCl溶液中水电离出的c(H+),即A>B,
故答案为:>;
②根据电荷守恒c(M+)+c(H+)=c(Cl-)+c(OH-)得:c(Cl-)-c(M+)=c(H+)-c(OH-)=10-6 mol/L-10-8 mol/L=9.9×10-7mol•L-1,
故答案为:9.9×10-7;
(2)25℃时,0.01mol•L-1 MOH溶液的pH=10,氢氧根离子浓度为10-4mol•L-1,pH=4的盐酸中氢离子浓度为10-4mol•L-1,由于MOH为弱碱,则反应后MOH过量,溶液显示碱性,即pH>7;MCl的水解方程式为:M++H2O?MOH+H+,则溶液中MCl的水解平衡常数Kh=$\frac{c(MOH)•c({H}^{+})}{c({M}^{+})}$=$\frac{\frac{{K}_{W}}{c(O{H}^{-})}}{\frac{c({M}^{+})}{c(MOH)}}$=$\frac{{K}_{W}}{{K}_{b}}$=10-8mol/L,
故答案为:>;10-8;
(3)①精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器有天平、药匙、玻棒、烧杯、胶头滴管、250mL容量瓶;
故答案为:250mL容量瓶;
②润洗时应尽量将待装液润洗整个滴定管,可边倾斜边转动,操作方法为彺滴定管中加入3到5ml 润洗液,将滴定管倾斜,使略有角度,旋转360度,将润洗液倒掉,重复3次,故答案为:彺滴定管中加入3到5ml 润洗液,将滴定管倾斜,使略有角度,旋转360度,将润洗液倒掉,重复3次;
③酸性溶液或强氧化性溶液应用酸式滴定管,故答案为:b.
点评 本题综合考查学生对实验原理与实验操作的理解、氧化还原反应滴定、化学计算等,为高考常见题型,难度中等,清楚实验原理是解题的关键,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力.

| A. | KCl | B. | CuSO4 | C. | HCl | D. | H2SO4 |
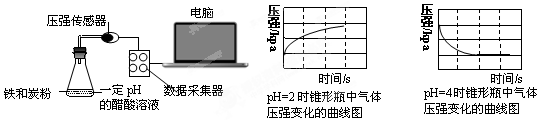
| A. | 溶液pH≤2时,生铁发生析氢腐蚀 | |
| B. | 生铁的腐蚀中化学腐蚀比电化学腐蚀更普遍 | |
| C. | 在酸性溶液中生铁可能发生吸氧腐蚀 | |
| D. | 两溶液中负极反应均为:Fe-2e-═Fe2+ |
| A. | 同主族元素形成的单质熔沸点自上而下逐渐升高 | |
| B. | 核外电子排布相同的微粒化学性质一定相同 | |
| C. | 同主族元素最高价含氧酸的酸性随核电荷数的增加而减弱 | |
| D. | 非金属元素的气态氢化物的稳定性越强其沸点就越高 |
| A. | 从溴水中萃取溴,可用酒精做萃取剂 | |
| B. | 蒸发实验完毕后,发现蒸发皿炸裂,这是因为没有垫石棉网 | |
| C. | 萃取碘水溶液中碘,分离碘四氯化碳溶液时,眼睛注视分液漏斗里液面 | |
| D. | 蒸馏时,为了加快水的流速,水应从上口进入,下口流出 |
①氢解反应:COS(g)+H2(g)?H2S(g)+CO(g)△H1=+7KJ•mol-1
②水解反应:COS(g)+H2O(g)?H2S(g)+CO2(g)△H2
已知反应中相关的化学键键能数据如下:
| 化学键 | C=O(CO2) | C=O(COS) | C=S | H-S | H-O |
| E/(KJ•mol-1) | 803 | 742 | 577 | 339 | 465 |
(1)在以上脱除COS的反应中,若某反应有1mol电子发生转移,则该反应吸收的热量为3.5KJ.
(2)已知热化学方程式CO(g)+H2O(g)?H2(g)+CO2(g)△H3 则△H3=-42KJ•mol-1.
(3)氢解反应平衡后增大容器的体积,则正反应速率减小,COS的转化率不变(填“增大”或“减小”或“不变”).
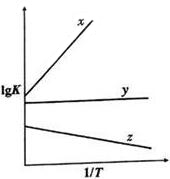
(4)COS氢解反应的平衡常数K与温度T具有如下的关系式lgK=$\frac{a}{T}$+b,式中a和b均为常数.
①如图中,表示COS氢解反应的直线为z,判断依据为氢解反应为吸热反应,升高温度,k增大.
②一定条件下,催化剂A和B对COS的氢解均具有催化作用,相关数据如下表所示:
| 达到平衡所需的时间/min | a的数值 | b的数值 | |
| 催化剂A | t | a1 | b1 |
| 催化剂B | 2t | a2 | b2 |
③某温度下,在体积不变的容器中,若COS和H2的起始体积比为1:V,平衡后COS和H2的体积比为1:10V,则此温度下该反应的化学平衡常数K=$\frac{81V}{10(V-1)^{2}}$.
(1)已知反应2H2+O2=H2O为放热反应,下图能正确表示该反应中能量变化的是A.
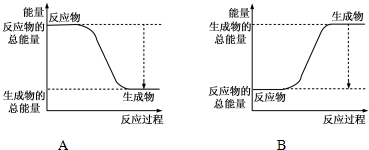
从断键和成键的角度分析上述反应中能量的变化.
| 化学键 | H-H | O=O | H-O |
| 键能kJ/mol | 436 | 496 | 463 |
(2)原电池可将化学能转化为电能.将质量相
同的铜棒和锌棒用导线连接后插入CuSO4溶液中,设计成原电池,负极材料是Zn,正极的反应式为Cu2++2e-=Cu,电解质溶液中SO42- 移向负极(填“正”或“负”).一段时间后,取出洗净、干燥、称量,二者质量差为12.9g.则导线中通过的电子的物质的量是0.2mol.
(3)一定温度下,将3molA气体和1mol B气体通入一容积固定为2L的密闭容器中,发生如下反应:3A(g)+B(g)?xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为0.2mol/(L•min);X为2.若反应经2min达到平衡,平衡时C的浓度小于0.8mol/L(填“大于,小于或等于”).
| A. | 达到化学平衡时,4 v正(O2)=5 v逆(NO) | |
| B. | 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 | |
| C. | 达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大 | |
| D. | 达到平衡时,若减小容器体积,则NH3的转化率会增大 |
 CH3COOCH2CH3+H2O,反应类型是酯化反应.
CH3COOCH2CH3+H2O,反应类型是酯化反应.