题目内容
19.下列是除去括号内杂质的有关操作,其中正确的是( )| A. | 分离苯和己烷--分液 | |
| B. | NO(NO2)--通过水洗、干燥后,用向下排气法收集 | |
| C. | 乙烷(乙烯)--让气体通过盛酸性高锰酸钾溶液的洗气瓶 | |
| D. | 乙醇(乙酸)--加足量NaOH溶液,蒸馏 |
分析 A.苯和己烷互溶;
B.二氧化氮与水反应,NO不能利用排空气法收集;
C.乙烯被高锰酸钾氧化生成二氧化碳;
D.乙酸与NaOH反应后,增大与乙醇的沸点差异.
解答 解:A.苯和己烷互溶,不能分液,应选蒸馏法,故A错误;
B.二氧化氮与水反应生成NO,NO不能利用排空气法收集,应排水法收集,故B错误;
C.乙烯被高锰酸钾氧化生成二氧化碳,引入新杂质二氧化碳,应选溴水、洗气,故C错误;
D.乙酸与NaOH反应后,增大与乙醇的沸点差异,然后蒸馏可分离,故D正确;
故选D.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异、发生的反应为解答的关键,侧重分析与应用能力的考查,注意除杂的原则及有机物的性质,题目难度不大.

练习册系列答案
相关题目
9.某同学在用稀硫酸与锌粒制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率.请回答下列问题:
(1)硫酸铜溶液可以加快氢气生成速率的原因是CuSO4与Zn反应产生的Cu与Zn形成铜锌原电池,加快了氢气产生的速率;
(2)要加快上述实验中气体产生的速率,还可采取的措施有升高反应温度、适当增加硫酸的浓度(答两种);
(3)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
①请完成此实验设计,其中:V1=30,V6=10,V9=17.5;
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积.
(1)硫酸铜溶液可以加快氢气生成速率的原因是CuSO4与Zn反应产生的Cu与Zn形成铜锌原电池,加快了氢气产生的速率;
(2)要加快上述实验中气体产生的速率,还可采取的措施有升高反应温度、适当增加硫酸的浓度(答两种);
(3)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol/L H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积.
7.下列化学反应的离子方程式书写正确的是( )
| A. | 把金属铁放入稀硫酸中:2Fe+6H+=2Fe3++3H2↑ | |
| B. | 往碳酸镁中滴加稀盐酸:MgCO3+2H+═CO2↑+H2O+Mg2+ | |
| C. | 向氢氧化铜中滴加稀盐酸:Cu(OH)2+2H+═Cu2++2H2O | |
| D. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-═BaSO4↓+H2O |
4.下列各组物质中,都是强电解质的是( )
| A. | HBr、HCl、HF | B. | BaSO4、NH4Cl、CH3COONa | ||
| C. | NaOH、Ca(OH)2、NH3•H2O | D. | HClO、CaCl2、SO2 |
8.下列各组物质熔化或升华时,所克服的粒子间作用属于同种类型的是( )
| A. | 碘和干冰升华 | B. | 镁和硫熔化 | ||
| C. | 氯化钠和蔗糖熔化 | D. | Na2O和SiO2熔化 |
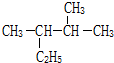 的系统命名为2,3-二甲基戊烷.
的系统命名为2,3-二甲基戊烷.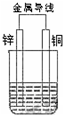 如图所示原电池
如图所示原电池