题目内容
9.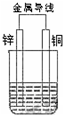 如图所示原电池
如图所示原电池(1)当电解质溶液为稀硫酸时,Cu片的电极反应式为2H++2e-=H2↑.
(2)当电解质溶液为CuSO4溶液时,Cu片的电极反应式为Cu2++2e-=Cu.
分析 (1)Cu不如Fe活泼,在稀硫酸中为正极,发生还原反应;
(2)当电解质溶液为CuSO4溶液时,Cu为正极,Cu被还原.
解答 解:(1)在稀硫酸中Cu作正极,发生还原反应,电极反应式为2H++2e-=H2↑,故答案为:2H++2e-=H2↑;
(2)当电解质溶液为CuSO4溶液时,Cu为正极,Cu被还原,电极反应式为:Cu2++2e-=Cu,故答案为:Cu2++2e-=Cu.
点评 本题考查原电池中电解质溶液对电极的影响,把握住问题的关键就是:负极发生氧化反应,正极发生还原反应即可.

练习册系列答案
相关题目
19.下列是除去括号内杂质的有关操作,其中正确的是( )
| A. | 分离苯和己烷--分液 | |
| B. | NO(NO2)--通过水洗、干燥后,用向下排气法收集 | |
| C. | 乙烷(乙烯)--让气体通过盛酸性高锰酸钾溶液的洗气瓶 | |
| D. | 乙醇(乙酸)--加足量NaOH溶液,蒸馏 |
20.某元素R在自然界只存在两种天然同位素,且它们的含量相近,R的相对原子质量为152,原子核外的电子数为63.下列关于R的叙述中错误的是( )
| A. | R不是主族元素 | B. | R是第六周期元素 | ||
| C. | R的原子核内有63个质子 | D. | R的一种同位素的核内有89个中子 |
17.下列叙述正确的是(用NA代表阿伏加德罗常数的值)( )
| A. | 2.4 g 金属镁变为镁离子时失去的电子数为0.1NA | |
| B. | 常温常压下,8.0g CH4中含有的价电子总数为5NA | |
| C. | 在标准状况下,22.4 L CH4与NH3混合气所含有的质子总数为10NA | |
| D. | 常温下,5.6g铁钉与足量浓硝酸反应,转移的电子数为0.3NA |
4.人造地球卫星用到的一种高能电池-银锌电池,它在放电时的电极反应为:
Zn+2OH--2e-═ZnO+H2O,
Ag2O+H2O+2e-═2Ag+2OH-
据此判断,下列说法正确的是( )
Zn+2OH--2e-═ZnO+H2O,
Ag2O+H2O+2e-═2Ag+2OH-
据此判断,下列说法正确的是( )
| A. | Ag2O作正极,被氧化 | |
| B. | 若将电解液换成酸性溶液,使用寿命会缩短 | |
| C. | Zn作正极,被还原 | |
| D. | OH-向正极移动 |
14.下列说法正确的是( )
| A. | Fe3+具有氧化性,Fe2+具有还原性 | |
| B. | Fe3+的水溶液呈红褐色,Fe2+的水溶液呈浅绿色 | |
| C. | Fe2+的溶液中滴入强碱溶液,立即出现红褐色沉淀 | |
| D. | 铁可以在氧气中燃烧生成Fe2O3 |
1.下列是除去括号内杂质的有关操作,其中正确的是( )
| A. | CO2(CO):通O2,点燃 | B. | CO(CO2):通过NaOH溶液 | ||
| C. | N2(O2):通过灼热的CuO | D. | CaO(CaCO3):加水,再过滤 |
18.下列关于化学反应速率的说法正确的是( )
| A. | 因是同一反应,所以用不同物质表示化学反应速率时,所得数值是相同的 | |
| B. | 根据化学反应速率的大小可以知道化学反应进行的快慢 | |
| C. | 化学反应速率为“1 mol/(L•min)”表示的意思是:时间为1 min 时,某物质的浓度为1 mol/L | |
| D. | 化学反应速率是指一定时间内任何一种反应物浓度的减少或者任何一种生成物浓度的增加 |
19.硫酸锌和轻质氧化镁在工业生产及食品添加等领域有重要应用.用高镁菱锌矿(主要含ZnCO3、MgCO3、CaCO3以及少量SiO2、Fe2O3、Cu等)进行联合生产.流程如图1:
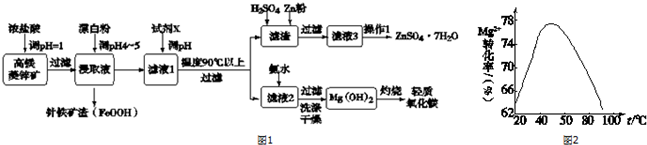
已知:金属离子沉淀的pH
(1)写出浸取过程中产生Fe2+的离子方程式Fe2O3+6H+=2Fe3++3H2O、2Fe3++Cu=2Fe2++Cu2+.
(2)下列说法正确的是acd.
a.用浓盐酸浸取前,将矿石粉碎能够提高浸出速率.
b.试剂X可以选择氨水,pH的范围在8.2~12.4之间.
c.控制温度在90℃以上的目的是为了促进Zn2+的水解.
d.滤渣中加入硫酸后再加入锌粉是为了出去Cu2+.
(3)由Fe2+生成针铁矿渣的离子反应方程式2Fe2++ClO-+3H2O=2FeOOH+Cl-+4H+.
(4)从滤液3中获取ZnSO4•7H2O的操作1是加热浓缩、冷却结晶、过滤、洗涤、干燥.
(5)加入氨水制备氢氧化镁的工艺过程要选择适宜条件.图2为反应温度与Mg2+转化率的关系.
①根据图中所示45℃前温度与Mg2+转化率之间的关系,可判断此反应是吸热(填“吸热”或“放热”)反应.
②50℃以上温度升高,Mg2+转化率下降的原因可能是温度过高时,氨水受热分解,浓度降低,Mg2+转化率下降.
③为了获取副产品CaCl2,经常用石灰乳代替氨水来制备氢氧化镁.用平衡移动原理解释石灰乳能够制备氢氧化镁的原因石灰乳中存在Ca(OH)2(s)?Ca2+(aq)+2OH-(aq),Mg2+可以与OH-反应生成更难溶的Mg(OH)2,使得OH-浓度不断下降,平衡右移,最终从Ca(OH)2转化为Mg(OH)2.

已知:金属离子沉淀的pH
| Zn2+ | Mg2+ | Cu2+ | Fe3+ | Fe2+ | |
| 开始沉淀pH | 5.9 | 9.4 | 4.7 | 2.7 | 7.6 |
| 完全沉淀pH | 8.2 | 12.4 | 6.7 | 3.7 | 9.6 |
(2)下列说法正确的是acd.
a.用浓盐酸浸取前,将矿石粉碎能够提高浸出速率.
b.试剂X可以选择氨水,pH的范围在8.2~12.4之间.
c.控制温度在90℃以上的目的是为了促进Zn2+的水解.
d.滤渣中加入硫酸后再加入锌粉是为了出去Cu2+.
(3)由Fe2+生成针铁矿渣的离子反应方程式2Fe2++ClO-+3H2O=2FeOOH+Cl-+4H+.
(4)从滤液3中获取ZnSO4•7H2O的操作1是加热浓缩、冷却结晶、过滤、洗涤、干燥.
(5)加入氨水制备氢氧化镁的工艺过程要选择适宜条件.图2为反应温度与Mg2+转化率的关系.
①根据图中所示45℃前温度与Mg2+转化率之间的关系,可判断此反应是吸热(填“吸热”或“放热”)反应.
②50℃以上温度升高,Mg2+转化率下降的原因可能是温度过高时,氨水受热分解,浓度降低,Mg2+转化率下降.
③为了获取副产品CaCl2,经常用石灰乳代替氨水来制备氢氧化镁.用平衡移动原理解释石灰乳能够制备氢氧化镁的原因石灰乳中存在Ca(OH)2(s)?Ca2+(aq)+2OH-(aq),Mg2+可以与OH-反应生成更难溶的Mg(OH)2,使得OH-浓度不断下降,平衡右移,最终从Ca(OH)2转化为Mg(OH)2.