题目内容
8.下列各组物质熔化或升华时,所克服的粒子间作用属于同种类型的是( )| A. | 碘和干冰升华 | B. | 镁和硫熔化 | ||
| C. | 氯化钠和蔗糖熔化 | D. | Na2O和SiO2熔化 |
分析 根据离子晶体熔化克服离子键,原子晶体熔化克服共价键,金属晶体熔化克服金属键,分子晶体熔化或升华克服分子间作用力,以此来解答.
解答 解:A、碘和干冰升华均属于分子晶体,升华时均克服分子间作用力,类型相同,故A正确;
B、镁是金属晶体和硫是分子晶体熔化分别克服金属键、硫熔化克服分子间作用力,故B错误;
C、NaCl和蔗糖分别属于离子晶体、分子晶体,NaCl熔化克服离子键、蔗糖熔化克服分子间作用力,故C错误;
D、Na2O和SiO2分别属于离子晶体、原子晶体,氧化钠熔化克服离子键,SiO2熔化克服共价键,类型不同,故D错误;
故选A.
点评 本题考查晶体类型及化学键,明确不同类型的晶体在熔化时克服不同的作用力是解答本题的关键,题目难度不大,注意把握晶体类型.

练习册系列答案
相关题目
19.下列是除去括号内杂质的有关操作,其中正确的是( )
| A. | 分离苯和己烷--分液 | |
| B. | NO(NO2)--通过水洗、干燥后,用向下排气法收集 | |
| C. | 乙烷(乙烯)--让气体通过盛酸性高锰酸钾溶液的洗气瓶 | |
| D. | 乙醇(乙酸)--加足量NaOH溶液,蒸馏 |
3.下列分子晶体中,关于熔、沸点高低的叙述正确的是( )
| A. | H2>N2>O2 | |
| B. | NH3>AsH3>PH3 | |
| C. | Cl2>Br2>I2 | |
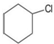
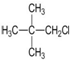
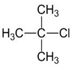
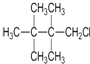
| D. | C(CH3)4>(CH3)2CHCH2CH3>CH3CH2CH2CH2CH3 |
20.某元素R在自然界只存在两种天然同位素,且它们的含量相近,R的相对原子质量为152,原子核外的电子数为63.下列关于R的叙述中错误的是( )
| A. | R不是主族元素 | B. | R是第六周期元素 | ||
| C. | R的原子核内有63个质子 | D. | R的一种同位素的核内有89个中子 |
17.下列叙述正确的是(用NA代表阿伏加德罗常数的值)( )
| A. | 2.4 g 金属镁变为镁离子时失去的电子数为0.1NA | |
| B. | 常温常压下,8.0g CH4中含有的价电子总数为5NA | |
| C. | 在标准状况下,22.4 L CH4与NH3混合气所含有的质子总数为10NA | |
| D. | 常温下,5.6g铁钉与足量浓硝酸反应,转移的电子数为0.3NA |
18.下列关于化学反应速率的说法正确的是( )
| A. | 因是同一反应,所以用不同物质表示化学反应速率时,所得数值是相同的 | |
| B. | 根据化学反应速率的大小可以知道化学反应进行的快慢 | |
| C. | 化学反应速率为“1 mol/(L•min)”表示的意思是:时间为1 min 时,某物质的浓度为1 mol/L | |
| D. | 化学反应速率是指一定时间内任何一种反应物浓度的减少或者任何一种生成物浓度的增加 |
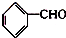
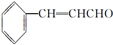 )在自然界存在于桂油中,是一种常用的植物调味油,工业上主要按如下路线合成:
)在自然界存在于桂油中,是一种常用的植物调味油,工业上主要按如下路线合成: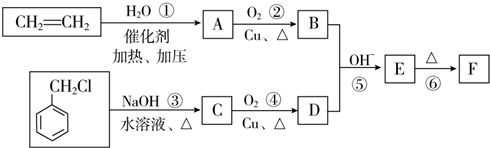
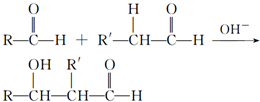
 ,检验其中官能团的试剂为银氨溶液或新制的Cu(OH)2悬浊液.
,检验其中官能团的试剂为银氨溶液或新制的Cu(OH)2悬浊液.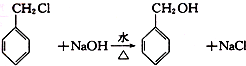 .
.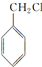 分子中的氯元素时,是将其中的氯元素转化为AgCl白色沉淀来进行的,其正确的操作步骤是BCDA(请用序号填写).
分子中的氯元素时,是将其中的氯元素转化为AgCl白色沉淀来进行的,其正确的操作步骤是BCDA(请用序号填写).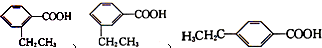 三种任写一种即可.
三种任写一种即可.