题目内容
11.回答下列问题:(1)戊烷(C5H12)的某种同分异构体只有一种一氯代物,试书写它的结构简式C(CH3)4.
(2)
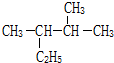 的系统命名为2,3-二甲基戊烷.
的系统命名为2,3-二甲基戊烷.(3)在101kPa下,CH4(g)、H2(g)、C(s)的燃烧热分别为890.3kJ?mo1-1、285.8
kJ?mo1-1和393.5kJ?mo1-1,则反应C(s)+2H2(g)=CH4(g)的反应热△H=-74.8kJ?mo1-1.
(4)己知:2H2(g)+O2(g)=2H2O(g)△H1
2H2(g)+O2(g)=2H2O(l)△H2
2CO(g)+O2(g)=2CO2(g)△H3
①液态水转化为气态水的热化学方程式为H2O(l)═H2O(g)△H=$\frac{△H1-△H2}{2}$.
②CO和H2分别燃烧生成CO2 (g)和H2O(g),欲得到相同热量,所需CO和H2的体积比是$\frac{△H1}{△H3}$.
分析 (1)先利用减链法书写同分异构体,然后根据一氯取代物的种类等于氢原子的种类写出结构简式;
(2)根据烷烃的系统命名法,主链5个C,甲基在2、3号C上.
(3)燃烧热是指1mol纯净物完全燃烧生成稳定的氧化物放出的热量,表示燃烧热的热化学方程式中可燃物为1mol,产物为稳定氧化物.碳单质、氢气、甲烷的热化学方程式分别为:
①C(s)+O2(g)═CO2(g)△H=-393.5kJ?mo1-1;
②H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8kJ?mo1-1;
③CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ?mo1-1,根据盖斯定律计算得到所需热化学方程式;
(4)①依据热化学方程式和盖斯定律计算得到所需热化学方程式;
②依据热化学方程式列式计算得到.
解答 解:(1)所有的碳原子在一条链上:CH3-CH2-CH2-CH2-CH3;
拿下1个碳原子作为支链: ;
;
拿下2个碳原子作为支链: ;
;
其中一种结构它的一氯代物只有一种结构,即只有一种氢原子,即为 ,即C(CH3)4,
,即C(CH3)4,
故答案为:C(CH3)4;
(2)主链5个C,甲基在2、3号C上,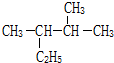 名称为2,3-二甲基戊烷;
名称为2,3-二甲基戊烷;
故答案为:2,3-二甲基戊烷;
(3)实验测得碳单质、氢气、甲烷的燃烧热(△H)分别为-393.5kJ/mol、-285.8kJ/mol、-890.3kJ/mol,则它们的热化学反应方程式分别为:
①C(s)+O2(g)═CO2(g)△H=-393.5kJ?mo1-1;
②H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8kJ?mo1-1;
③CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ?mo1-1,
根据盖斯定律,由①+②×2-③得,C(s)+2H2(g)=CH4(g),△H=[(-393.5kJ?mo1-1)+(-285.8kJ?mo1-1)×2]-(-890.3kJ?mo1-1)=-74.8kJ?mo1-1,
故答案为:-74.8kJ?mo1-1;
(6)①2H2(g)+O2(g)=2H2O(g)△H1
2H2(g)+O2(g)=2H2O(l)△H2
两式相减除以2得到:H2O(l)═H2O(g)△H=$\frac{△H1-△H2}{2}$;
故答案为:H2O(l)═H2O(g)△H=$\frac{△H1-△H2}{2}$;
②CO和H2分别燃烧生成CO2(g)和H2O(g),欲得到相同热量,设氢气和一氧化碳物质的量分别为x,y
2H2(g)+O2(g)=2H2O(g)△H1
2△H1
x $\frac{x△H1}{2}$
2CO(g)+O2(g)=2CO2(g)△H3
2△H3
y $\frac{y△H3}{2}$
欲得到相同热量,即$\frac{x△H1}{2}$=$\frac{y△H3}{2}$,所需CO和H2的体积比等于物质的量之比=$\frac{△H1}{△H3}$.
故答案为:$\frac{△H1}{△H3}$.
点评 本题主要考查了同分异构体、烷烃的命名,热化学方程式的书写,需要注意的有:物质的状态、反应热的数值与单位,反应热的数值与化学方程式前面的系数成正比,注意盖斯定律的运用.

 名校课堂系列答案
名校课堂系列答案| 浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 35 | 0.32 | 0.34 | 0.15 |
(2)根据表中数据,计算平衡时的NO转化率为60%.
(3)根据表中数据,计算T℃时该反应的平衡常数为0.56.
(4)30~35min改变的实验条件是分离出CO2.
| A. | 1:1 | B. | 2:1 | C. | 1:2 | D. | 无法计算 |
| A. | 分离苯和己烷--分液 | |
| B. | NO(NO2)--通过水洗、干燥后,用向下排气法收集 | |
| C. | 乙烷(乙烯)--让气体通过盛酸性高锰酸钾溶液的洗气瓶 | |
| D. | 乙醇(乙酸)--加足量NaOH溶液,蒸馏 |
| A. | △H<0的反应均是自发反应 | |
| B. | 自发进行的反应一定能迅速进行 | |
| C. | 高锰酸钾加热分解是一个熵减小的过程 | |
| D. | 冰在室温下自动熔化成水,是熵增的重要结果 |
| A. | H2>N2>O2 | |
| B. | NH3>AsH3>PH3 | |
| C. | Cl2>Br2>I2 | |
| D. | C(CH3)4>(CH3)2CHCH2CH3>CH3CH2CH2CH2CH3 |
| A. | R不是主族元素 | B. | R是第六周期元素 | ||
| C. | R的原子核内有63个质子 | D. | R的一种同位素的核内有89个中子 |
| A. | CO2(CO):通O2,点燃 | B. | CO(CO2):通过NaOH溶液 | ||
| C. | N2(O2):通过灼热的CuO | D. | CaO(CaCO3):加水,再过滤 |