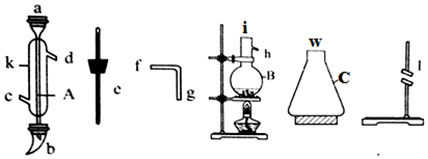
题目内容
6.下列变化过程对应的现象正确的是( )| 选项 | 变化过程 | 现象 |
| A | 将少量酚酞滴加到过氧化钠固体上 | 变红 |
| B | 将过量氯气通入紫色石蕊试液中 | 褪色 |
| C | 过量氨水逐滴加入氯化铝溶液中 | 先产生白色沉淀后白色沉淀消失 |
| D | 氢氧化铁胶体中加入过量稀硫酸 | 先产生红褐色沉淀后溶解,溶液变为黄色 |
| A. | A | B. | B | C. | C | D. | D |
分析 A、过氧化钠可以和水反应生成氢氧化钠和氧气,反应放热并且生成的氢氧化钠具有碱性可以使酚酞变红,而过氧化钠具有强氧化性;
B、氯气与水反应Cl2+H2O=HCl+HClO,依据盐酸与次氯酸的性质解答;
C、氢氧化铝不溶于弱碱氨水;
D、氢氧化铁胶体中加入稀硫酸胶体的聚沉产生红褐色沉淀,硫酸过量胶体溶解生成硫酸铁溶液.
解答 解:A、过氧化钠可以和水反应生成氢氧化钠和氧气,反应放热并且生成的氢氧化钠具有碱性可以使酚酞变红,而过氧化钠具有强氧化性,后褪色,故A错误;
B、氯气通入紫色石蕊试液中,氯气与水反应Cl2+H2O=HCl+HClO,盐酸具有酸性,能够使石蕊变红,次氯酸具有漂白性,能够使变红的溶液褪色,故B错误;
C、过量氨水逐滴加入氯化铝溶液中,产生白色沉淀后白色沉淀不消失,故C错误;
D、氢氧化铁胶体中加入稀硫酸胶体的聚沉产生红褐色沉淀,硫酸过量胶体溶解生成硫酸铁溶液,所以溶液呈黄色,故D正确;
故选D.
点评 本题考查了元素化合物的性质,应注意胶体具有聚沉、氢氧化铝的两性,只溶于强酸强碱,掌握基础是解题关键,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13.下列实验装置能达到实验目的是(夹持仪器未画出)( )
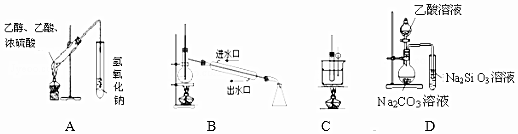

| A. | 装置用于制备乙酸乙酯 | |
| B. | 装置用于石油的分馏 | |
| C. | 装置用于实验室制硝基苯 | |
| D. | 装置可装置证明酸性:乙酸>碳酸>硅酸 |
14.下列说法不正确的是( )
| A. | 室温下,用pH试纸测定浓度为0.1mol•L-1 NaClO溶液的pH | |
| B. | 将4mL0.01mol•L-1 KSCN溶液与1mL0.01mol•L-1 FeCl3溶液充分混合,再继续加入KSCN溶液,溶液颜色加深,证明溶液中存在平衡::Fe3++3SCN-?Fe(SCN)3 | |
| C. | 将碱的稀溶液缓慢倒人酸的稀溶液中.所测反应后混合液温度值偏小 | |
| D. | 测定Na2SO3溶液与Na2CO3溶液的酸碱性,说明非金属性:S>C |
14.金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝.高温下,在密闭容器中用H2还原WO3可得到金属钨,其总反应为:WO3(s)+3H2(g)$\stackrel{高温}{?}$W(s)+3H2O(g)
请回答下列问题:
(1)上述反应的化学平衡常数表达式为$\frac{{c}^{3}({H}_{2}O)}{{c}^{3}({H}_{2})}$.
(2)某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为60%;随温度的升高,H2与水蒸气的体积比减小,则该反应为反应吸热(填“吸热”或“放热”).
(3)上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如表所示:
第一阶段反应的化学方程式为2WO3+H2$\frac{\underline{\;高温\;}}{\;}$W2O5+H2O.
请回答下列问题:
(1)上述反应的化学平衡常数表达式为$\frac{{c}^{3}({H}_{2}O)}{{c}^{3}({H}_{2})}$.
(2)某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为60%;随温度的升高,H2与水蒸气的体积比减小,则该反应为反应吸热(填“吸热”或“放热”).
(3)上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如表所示:
| 温度 | 25℃~550℃~600℃~700℃ |
| 主要成份 | WO3 W2O5 WO2 W |
18.已知下列热化学方程式:
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•mol-1
H2(g)+O2(g)═H2O(g)△H=-241.8kJ•mol-1
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
则氢气的燃烧热是( )
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•mol-1
H2(g)+O2(g)═H2O(g)△H=-241.8kJ•mol-1
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
则氢气的燃烧热是( )
| A. | 483.6 kJ•mol-1 | B. | 241.8 kJ•mol-1 | C. | 571.6 kJ•mol-1 | D. | 285.8 kJ•mol-1 |
16.设NA代表阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 标准状况下,1 mol CO2、CO的混合气中含有的氧原子数为1.5NA | |
| B. | 标准状况下,11.2LCCl4所含的分子数为0.5 NA | |
| C. | 25℃,1.01×105Pa,66gCO2中所含原子数为4.5NA | |
| D. | 1 mol•L-1 CuCl2溶液中含有的氯离子数为2NA |
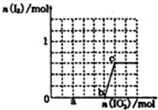 (1)铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
(1)铁及其化合物在生活、生产中有广泛应用.请回答下列问题: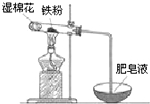 铝和铁是日常生活中用途广泛的金属.
铝和铁是日常生活中用途广泛的金属.