题目内容
2.实验室需要0.80mol•L-1NaOH溶液475mL和0.40mol•L-1硫酸500mL.根据这两种溶液的配制情况,回答下列问题.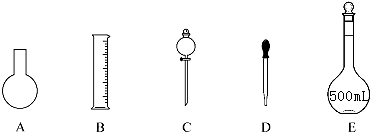
(1)如图所示的仪器中配制溶液肯定不需要的是AC(填序号),配制上述溶液还需用到的玻璃仪器是烧杯、玻璃棒(填仪器名称).
(2)容量瓶所不具备的功能有BCD(填序号).
A.配制一定体积准确浓度的标准溶液 B.用来加热溶解固体溶质
C.测量容量瓶规格以下的任意体积的液体 D.贮存溶液
(3)根据计算用托盘天平称取NaOH的质量为16.0g.在实验中其他操作均正确,若容量瓶用蒸馏水洗涤后未干燥,则所得溶液浓度等于0.80mol•L-1(填“大于”“等于”或“小于”,下同).若未等溶液冷却就定容,则所得溶液浓度大于0.80mol•L-1.
(4)根据计算得知,题中所需质量分数为98%、密度为1.84g•cm-3的浓硫酸的体积为10.9mL(计算结果保留一位小数).如果实验室有10mL、15mL、20mL、50mL的量筒,最好选用15mL的量筒.
分析 (1)根据配制一定物质的量浓度的溶液的步骤确定所用仪器进行判断;
(2)容量瓶是配制一定体积准确浓度的标准溶液的定容仪器,不能用于量取溶液,也不能溶解、贮存溶液;
(3)依据n=c×V m=n×M计算氢氧化钠的质量,依据c=$\frac{n}{V}$分析实验操作对n和V的影响;
(4)先依据c=$\frac{1000ρω}{M}$计算浓硫酸的浓度,然后依据稀释前后溶质的物质的量保持不变计算所需浓硫酸的体积,根据需要浓硫酸的体积确定选用量筒的规格.
解答 解:(1)配制一定物质的量浓度的溶液需要的仪器有:托盘天平、量筒、药匙、烧杯、玻璃杯、500ml的容量瓶、胶头滴管,不需要的是圆底烧瓶、分液漏斗,
故答案为:A、C;烧杯、玻璃棒;
(2)容量瓶作为精密仪器不可用于储存和加热溶解固体、稀释液体,也不能测量除其规格以外容积的液体体积,只能用于配制一定物质的量浓度的溶液,故A正确、BCD错误,
故答案为:BCD;
(3)需要氢氧化钠的物质的量n=C×V=0.80mol•L-1 ×0.5L=0.4mol,质量为m=n×M=0.4mol×40g/mol=16.0g,
依据c=$\frac{n}{V}$:若容量瓶用蒸馏水洗涤后未干燥,对溶质的物质的量和溶液的体积不会造成影响,浓度无影响;
若还未等溶液冷却就定容了,则会导致溶液的体积偏小,浓度偏大,
故答案为:16.0;等于;大于;
(4)浓硫酸的浓度为c=$\frac{1000ρω}{M}$=$\frac{1000×1.84×98%}{98}$=18.4mol/L,设需要浓硫酸的体积为V则:18.4mol/L×V=0.40mol•L-1×0.5L,解得:V=0.0109L=10.9mL,应选择15mL的量筒,
故答案为:10.9;15.
点评 本题考查一定物质的量浓度溶液的方法,题目难度不大,明确配制原理是解题关键,注意容量瓶规格的选择和使用注意事项,试题侧重基础知识的考查,有利于提高学生的化学实验能力.

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案①我国科学家在世界上第一次人工合成结晶牛胰岛素;
②最早发现电子的是英国科学家道尔顿;
③测定有机化合物中碳、氢元素质量分数的方法最早由李比希提出;
④荷兰化学家范特霍夫提出碳原子成键的新解释,成功地解决了二取代甲烷只有一种结构的问题;
⑤首先在实验室合成尿素的是维勒,
其中正确的是( )
| A. | 只有① | B. | ①和③ | C. | ①②③⑤ | D. | ①③④⑤ |
| A. | 断裂1 mol H2O中的化学键需要吸收925.6 KJ的能量 | |
| B. | 2H2(g)+O2(g)═2H2O(g)△H=-480.4 KJ•mol-1 | |
| C. | 2H2O(l)═2H2(g)+O2(g)△H=471.6 KJ•mol-1 | |
| D. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-240.2KJ•mol-1 |
| A. | 室温下,用pH试纸测定浓度为0.1mol•L-1 NaClO溶液的pH | |
| B. | 将4mL0.01mol•L-1 KSCN溶液与1mL0.01mol•L-1 FeCl3溶液充分混合,再继续加入KSCN溶液,溶液颜色加深,证明溶液中存在平衡::Fe3++3SCN-?Fe(SCN)3 | |
| C. | 将碱的稀溶液缓慢倒人酸的稀溶液中.所测反应后混合液温度值偏小 | |
| D. | 测定Na2SO3溶液与Na2CO3溶液的酸碱性,说明非金属性:S>C |
请回答下列问题:
(1)上述反应的化学平衡常数表达式为$\frac{{c}^{3}({H}_{2}O)}{{c}^{3}({H}_{2})}$.
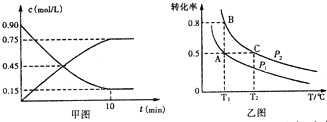
(2)某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为60%;随温度的升高,H2与水蒸气的体积比减小,则该反应为反应吸热(填“吸热”或“放热”).
(3)上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如表所示:
| 温度 | 25℃~550℃~600℃~700℃ |
| 主要成份 | WO3 W2O5 WO2 W |
 铝和铁是日常生活中用途广泛的金属.
铝和铁是日常生活中用途广泛的金属.