题目内容
2.某固体粉末X由两种物质组成,为确定该固体粉末的成分,某同学进行了以下实验:①将固体粉末X加入足量稀盐酸中,有红色不溶物出现,同时有气泡产生;
②取①中的溶液加适量的H2O2溶液,再滴入KSCN溶液,溶液显红色
则该固体粉末X可能为( )
| A. | Zn、CuO | B. | Fe、Al2O3 | C. | Fe、CuO | D. | Cu、FeO |
分析 ①将固体粉末X加入足量稀盐酸中,有红色不溶物出现,为金属铜,同时有气泡产生,可为氢气,说明含有活泼金属;
②取①中的溶液加适量的H2O2溶液,再滴入KSCN溶液,溶液显红色,说明生成铁离子,活泼金属为铁,以此解答该题.
解答 解:A.含有Zn,反应后滴入KSCN溶液,溶液不显红色,故A错误;
B.加入稀盐酸,没有红色不溶物,故B错误;
C.含有铁、氧化铜,加入盐酸生成铜和氢气,加入过氧化氢,生成铁离子,再滴入KSCN溶液,溶液显红色,故C正确;
D.加入盐酸,没有气体生成,故D错误.
故选C.
点评 本题考查物质的鉴别与检验,为高频考点,把握物质的性质、发生的反应与现象为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
相关题目
12.下列说法正确的是( )
| A. | 工业上常通过电解熔融的MgO冶炼金属镁 | |
| B. | 应用盖斯定律,可计算某些难以直接测量的反应焓变 | |
| C. | 用惰性电极电解Na2SO4溶液,阴、阳两极产物的物质的量之比为1:2 | |
| D. | 已知:①2H2(g)+O2(g)=2H2O(g)△H=-aKJ/mol ②2H2(g)+O2(g)═2H2O(l)△H=-bKJ/mol△H1<△H2 |
13.下列实验装置能达到实验目的是(夹持仪器未画出)( )
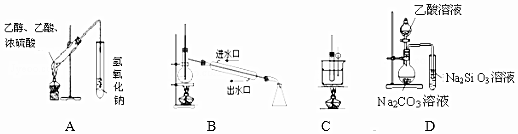

| A. | 装置用于制备乙酸乙酯 | |
| B. | 装置用于石油的分馏 | |
| C. | 装置用于实验室制硝基苯 | |
| D. | 装置可装置证明酸性:乙酸>碳酸>硅酸 |
17.下列关于电解质溶液的叙述正确的是( )
| A. | 常温下电离常数为Ka的酸HA溶液中c(H+)$\sqrt{{K}_{a}}$mol•L-1 | |
| B. | 向0.1 mol•L-1的氨水中加入少量硫酸铵固体,则溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$增大 | |
| C. | 0.2 mol•L-1CH3COOH溶液与0.1 mol•L-1NaOH溶液等体积混合:2c(H+)-2 c(OH-)═c(CH3COO-)-c(CH3COOH) | |
| D. | 将饱和Na2SO4溶液加入到饱和石灰水中,有白色沉淀产生,说明Ksp[Ca(OH)2]大于Ksp(CaSO4) |
7.已知断裂1mol H2(g)中的H-H键需要吸收436.4KJ的能量,断裂1mol O2(g)中的共价键需要吸收498KJ的能量,生成H2O(g)中的1mol H-O键能放出462.8KJ的能量.下列说法正确的是( )
| A. | 断裂1 mol H2O中的化学键需要吸收925.6 KJ的能量 | |
| B. | 2H2(g)+O2(g)═2H2O(g)△H=-480.4 KJ•mol-1 | |
| C. | 2H2O(l)═2H2(g)+O2(g)△H=471.6 KJ•mol-1 | |
| D. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-240.2KJ•mol-1 |
14.下列说法不正确的是( )
| A. | 室温下,用pH试纸测定浓度为0.1mol•L-1 NaClO溶液的pH | |
| B. | 将4mL0.01mol•L-1 KSCN溶液与1mL0.01mol•L-1 FeCl3溶液充分混合,再继续加入KSCN溶液,溶液颜色加深,证明溶液中存在平衡::Fe3++3SCN-?Fe(SCN)3 | |
| C. | 将碱的稀溶液缓慢倒人酸的稀溶液中.所测反应后混合液温度值偏小 | |
| D. | 测定Na2SO3溶液与Na2CO3溶液的酸碱性,说明非金属性:S>C |
14.金属钨用途广泛,主要用于制造硬质或耐高温的合金,以及灯泡的灯丝.高温下,在密闭容器中用H2还原WO3可得到金属钨,其总反应为:WO3(s)+3H2(g)$\stackrel{高温}{?}$W(s)+3H2O(g)
请回答下列问题:
(1)上述反应的化学平衡常数表达式为$\frac{{c}^{3}({H}_{2}O)}{{c}^{3}({H}_{2})}$.
(2)某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为60%;随温度的升高,H2与水蒸气的体积比减小,则该反应为反应吸热(填“吸热”或“放热”).
(3)上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如表所示:
第一阶段反应的化学方程式为2WO3+H2$\frac{\underline{\;高温\;}}{\;}$W2O5+H2O.
请回答下列问题:
(1)上述反应的化学平衡常数表达式为$\frac{{c}^{3}({H}_{2}O)}{{c}^{3}({H}_{2})}$.
(2)某温度下反应达平衡时,H2与水蒸气的体积比为2:3,则H2的平衡转化率为60%;随温度的升高,H2与水蒸气的体积比减小,则该反应为反应吸热(填“吸热”或“放热”).
(3)上述总反应过程大致分为三个阶段,各阶段主要成分与温度的关系如表所示:
| 温度 | 25℃~550℃~600℃~700℃ |
| 主要成份 | WO3 W2O5 WO2 W |