题目内容
9.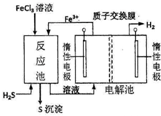 现代工业生产中常用电解氯化亚铁的方法制得氯化铁溶液吸收有毒的硫化氢气体.工艺原理如图所示.下列说法中不正确的是( )
现代工业生产中常用电解氯化亚铁的方法制得氯化铁溶液吸收有毒的硫化氢气体.工艺原理如图所示.下列说法中不正确的是( )| A. | 左槽中发生的反应是:2Cl--2e-═Cl2↑ | |
| B. | 右槽中的反应式:2H++2 e-═H2↑ | |
| C. | H+从电解池左槽迁移到右槽 | |
| D. | FeCl3溶液可以循环利用 |
分析 FeCl3溶液氧化H2S发生反应:2FeCl3+H2S=2FeCl2+2HCl+S↓,反应池中溶液移入电解池左槽,而电解池左槽产生Fe3+,右槽生成氢气,因此左槽为阳极、右槽为阴极,由于还原性Fe2+>Cl-,左槽中Fe2+放电生成Fe3+,右槽中氢离子放电生成氢气,质子通过质子交换膜移向阴极.
解答 解:通过图示可知Fe2+在电解池的左槽中转化为Fe3+,H+在右槽转化为H2,因此左槽为阳极右槽为阴极.A.左槽为阳极,由于还原性Fe2+>Cl-,因此电极反应式为:Fe2+-e-=Fe3+,故A错误;
B.右槽为阴极,因此电极反应式为:2H++2e-=H2↑或2H2O=H2↑+2OH-,故B正确;
C.电解过程中阳离子向阴极移动,故C正确;
D.在反应池中FeCl3和H2S反应为:2Fe3++H2S=2 Fe2++S+2H+,因此FeCl3溶液可以循环利用,故D正确,
故选:A.
点评 本题考查电解工作原理,电解本质是氧化还原反应,理解电极反应与离子的放电顺序是关键,难度不大.

练习册系列答案
相关题目
18.500mLKNO3和Cu(NO3)2的混合溶液中c(NO3-)为6.0mol•L-1,用石墨电极电解此溶液,当通电一段时间后,两极均收到22.4L气体(标准状况),假定电解后溶液体积仍为500mL,下列说法正确的是( )
| A. | 原混合溶液中c(K+)为4mol/L | |
| B. | 原溶液中c(Cu2+)为1mol/L | |
| C. | 电解后溶液中c(H+)为8mol/L | |
| D. | 电解后加入1molCu(OH)2可使溶液复原 |
14.有温度和容积均相同的两容器Ⅰ、Ⅱ,向Ⅰ中加入1mol NO2,Ⅱ中加入2mol NO2,都将发生反应2NO2(g)?N2O4(g),反应达到平衡时,测得Ⅰ中NO2的转化率为a%,Ⅱ中NO2的转化率为b%,则a、b的关系为( )
| A. | a<b | B. | a>b | C. | a=b | D. | 无法确定 |
 Ⅰ、某化学实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和反应反应热的测定
Ⅰ、某化学实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和反应反应热的测定
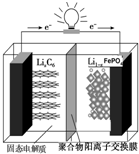 磷酸铁锂动力电池(LiFePO4电池)的内部结构如图所示.中间是聚合物的隔膜,它把正极与负极隔开,锂离子可以通过而电子不能通过.该电池的总反应式为:Li1-xFePO4+LixC6═C6+LiFePO4
磷酸铁锂动力电池(LiFePO4电池)的内部结构如图所示.中间是聚合物的隔膜,它把正极与负极隔开,锂离子可以通过而电子不能通过.该电池的总反应式为:Li1-xFePO4+LixC6═C6+LiFePO4