题目内容
9.某羧酸脂的分子式为为C16H14O4,1mol该酯完全水解可得到2mol羧酸和1mol乙二醇(HOCH2-CH2OH),该羧酸的分子式为( )| A. | C7H6O2 | B. | C8H8O4 | C. | C14H12O2 | D. | C6H6O4 |
分析 某羧酸酯的分子式为C16H14O4,1mol该酯完全水解可得到2mol羧酸和1mol乙二醇,令羧酸为A,则水解反应表示为:C16H14O4+2H2O→2A+HOCH2-CH2OH,根据原子守恒确定羧酸分子式.
解答 解:某羧酸酯的分子式为C16H14O4,1mol该酯完全水解可得到2mol羧酸和1mol乙二醇,令羧酸为A,则水解反应表示为:C16H14O4+2H2O→2A+HOCH2-CH2OH,根据原子守恒,可知羧酸分子式为C7H6O2,
故选:A.
点评 本题考查有机物分子式的确定,关键理解酯的水解原理,结合原子守恒解答,比较基础.

练习册系列答案
相关题目
19.“嫦娥三号”携带的“玉兔号”月球车使用的耐压外壳为钛合金.某种超高硬度钛合金含Ti、A1、V、Cr、Si等元素,该钛合金中硅元素在周期表中的位置为( )
| A. | 第三周期ⅣA族 | B. | 第三周期ⅢA族 | C. | 第四周期ⅣA族 | D. | 第四周期ⅣB族 |
20.常见的有机反应类型有:①取代 ②加成 ③消去 ④酯化 ⑤加聚 ⑥水解 ⑦还原.其中能在有机化合物中引入-OH的反应类型有( )
| A. | ①②③④⑤⑥ | B. | ③④⑤⑥ | C. | ②③④⑤ | D. | ②⑥⑦ |
17.下列各组物质中,化学键类型相同,化合物类型也相同的是( )
| A. | SO2 Na2SO4 | B. | CH4 H2O | C. | KCl HCl | D. | NaOH Cl2 |
4.有关 分子结构的叙述中正确的是( )
分子结构的叙述中正确的是( )
 分子结构的叙述中正确的是( )
分子结构的叙述中正确的是( )| A. | 分子中一定在同一平面上的碳原子至少为5个 | |
| B. | 分子中可能在同一平面上的碳原子最多为8个 | |
| C. | 分子中所有的碳原子有可能都在同一平面上 | |
| D. | 分子中在同一直线上的碳原子数为4 |
1.下列有关电池的叙述正确的是( )
| A. | 锌锰电池工作一段时间后外皮会变薄 | |
| B. | 太阳能电池的主要材料是高纯度的二氧化硅 | |
| C. | 如图所示电池工作时,负极溶解3g,溶液质量减轻0.2g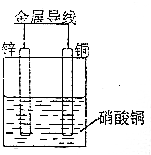 | |
| D. | 氢氧燃料电池工作时氢气在负极氧化 |
18.下列关于元素原子或离子半径的比较.正确的是( )
| A. | r(Al)>r(Si)>r(C)>r(N) | B. | r(Na+)<r(Mg2+)<r(Al3+)<r(F-) | ||
| C. | r(K+)>r(Ca2+)>r(S2-)>r(Cl-) | D. | r(N)<r(S)<r(O)<r(P) |
1.如图是工业上生产碳酸锂的部分工艺流程,请根据流程图及已知信息回答问题.
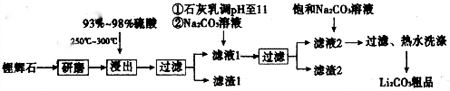
已知:①锂辉石主要万分为Li2O•Al2O3•4SiO2,含有少量Ca、Mg元素.
②Li2O•Al2O3•4SiO2+H2SO4(浓)$\frac{\underline{\;250-300℃\;}}{\;}$Li2SO4+Al2O3•4SiO2•H2O↓
③几种物质不同温度下的溶解度.
(1)从滤渣1中分离出Al2O3的部分流程如下图所示,括号表示加入的试剂,方框表示所得到的物质.写出图中①、②、③表示的各物质,步骤II中反应的离子方程式是Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
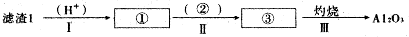
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3,写出生成滤渣2反应的离子方程式:Mg2++2OH-=Mg(OH)2↓,Ca2++CO32-=CaCO3↓.
(3)向滤液2中加入饱和Na2CO,溶液,过滤后,用“热水洗涤”的原因是Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失.
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下.
①将粗产品Li2CO3溶于盐酸作用解槽的阳极液,LiOH溶液作阴极液,两者用离子选择半透膜隔开,用惰性电极电解.阳极的电极反应式是2C1--2e-=Cl2↑.
②电解后向产品LiOH溶液中加入过量NH4HCO,溶液生成Li2CO3反应的化学方程式是2LiOH+2NH4HCO3=Li2CO3+(NH4)2CO3+2H2O.

已知:①锂辉石主要万分为Li2O•Al2O3•4SiO2,含有少量Ca、Mg元素.
②Li2O•Al2O3•4SiO2+H2SO4(浓)$\frac{\underline{\;250-300℃\;}}{\;}$Li2SO4+Al2O3•4SiO2•H2O↓
③几种物质不同温度下的溶解度.
| T/℃ | 20 | 40 | 60 | 80 |
| S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
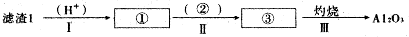
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3,写出生成滤渣2反应的离子方程式:Mg2++2OH-=Mg(OH)2↓,Ca2++CO32-=CaCO3↓.
(3)向滤液2中加入饱和Na2CO,溶液,过滤后,用“热水洗涤”的原因是Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失.
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下.
①将粗产品Li2CO3溶于盐酸作用解槽的阳极液,LiOH溶液作阴极液,两者用离子选择半透膜隔开,用惰性电极电解.阳极的电极反应式是2C1--2e-=Cl2↑.
②电解后向产品LiOH溶液中加入过量NH4HCO,溶液生成Li2CO3反应的化学方程式是2LiOH+2NH4HCO3=Li2CO3+(NH4)2CO3+2H2O.