题目内容
18.下列关于元素原子或离子半径的比较.正确的是( )| A. | r(Al)>r(Si)>r(C)>r(N) | B. | r(Na+)<r(Mg2+)<r(Al3+)<r(F-) | ||
| C. | r(K+)>r(Ca2+)>r(S2-)>r(Cl-) | D. | r(N)<r(S)<r(O)<r(P) |
分析 同周期自左而右原子半径减小,同主族自上而下原子半径减小,一般电子层越多原子半径越大;电子层结构相同的离子,核电荷数越大离子半径越小,离子的电子层越多离子半径越大.
解答 解:A.同周期自左而右原子半径减小,同主族自上而下原子半径减小,故原子半径:r(Al)>r(Si)>r(C)>r(N),故A正确;
B.电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:r(Al3+)<r(Mg2+)<r(Na+)<r(F-),故B错误;
C.电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:r(S2-)>r(Cl-)>r(K+)>r(Ca2+),故C错误;
D.同周期自左而右原子半径减小,同主族自上而下原子半径减小,一般电子层越多原子半径越大,则原子半径:r(O)<r(N)<r(S)<r(P),故D错误.
故选:A.
点评 本题考查微粒半径大小,注意掌握微粒半径比较规律,从结构上理解同主族、同周期原子半径递变规律.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
8.证明溴乙烷中溴原子的存在,下列正确的操作步骤为( )
①加入AgNO3溶液 ②加入NaOH水溶液 ③加热
④加入蒸馏水 ⑤加稀硝酸至溶液呈酸性 ⑥加入NaOH醇溶液.
①加入AgNO3溶液 ②加入NaOH水溶液 ③加热
④加入蒸馏水 ⑤加稀硝酸至溶液呈酸性 ⑥加入NaOH醇溶液.
| A. | ④③①⑤ | B. | ③⑥⑤① | C. | ②③① | D. | ②③⑤① |
9.某羧酸脂的分子式为为C16H14O4,1mol该酯完全水解可得到2mol羧酸和1mol乙二醇(HOCH2-CH2OH),该羧酸的分子式为( )
| A. | C7H6O2 | B. | C8H8O4 | C. | C14H12O2 | D. | C6H6O4 |
5.下列各组物质全部是弱电解质的是( )
| A. | H2SiO3 H2S CO2 | |
| B. | H2O NH3•H2O HClO HF | |
| C. | H2SO3 Ba(OH)2 BaSO4 | |
| D. | Cu(OH)2 CH3COOH C2H5OH CH3COONa |
12. 某无色稀溶液X中,可能含有如表所列离子中的某几种.
某无色稀溶液X中,可能含有如表所列离子中的某几种.
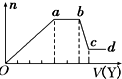
取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(V)的关系如图所示下列说法正确的是( )
 某无色稀溶液X中,可能含有如表所列离子中的某几种.
某无色稀溶液X中,可能含有如表所列离子中的某几种.| 阴离子 | CO32-、SiO32-、AlO2-、Cl- |
| 阳离子 | Al3+、Fe3+、Mg2+、NH4+、Na+ |
| A. | 若Y是盐酸,则X中一定含有CO32-、SiO32-、AlO2-和Na+ | |
| B. | 若Y是NaOH溶液,则X中一定含有Al3+、Fe3+、NH4+、Cl- | |
| C. | 若Y是NaOH溶液,则ab段发生反应的离子方程式为:NH4++OH-═NH3↑+H2O | |
| D. | 若Y是NaOH溶液,则X中的Al3+、Mg2+、NH4+ 物质的量之比为1:1:2 |
9.某烃不与溴水反应,能使酸性高锰酸钾溶液褪色,在Fe存在下与Cl2反应,能生成两种一氯代物,该烃是( )
| A. | 丙烯 | B. | 对二甲苯 | C. |  | D. |  |
10.关于溶液、浊液、胶体说法正确的是( )
| A. | 均能产生丁达尔现象 | B. | 都是混合物 | ||
| C. | 分散质均能透过半透膜 | D. | 分散质均能通过滤纸 |
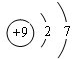 ,Z单质与H2O反应的化学方程式为2H2O+2F2=4HF+O2,在该反应中,氧化剂与还原剂的物质的量之比为1:1.
,Z单质与H2O反应的化学方程式为2H2O+2F2=4HF+O2,在该反应中,氧化剂与还原剂的物质的量之比为1:1.