题目内容
1.下列有关电池的叙述正确的是( )| A. | 锌锰电池工作一段时间后外皮会变薄 | |
| B. | 太阳能电池的主要材料是高纯度的二氧化硅 | |
| C. | 如图所示电池工作时,负极溶解3g,溶液质量减轻0.2g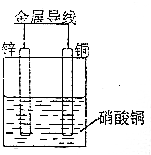 | |
| D. | 氢氧燃料电池工作时氢气在负极氧化 |
分析 A.锌锰电池工作时,锌为负极被氧化;
B.太阳能电池的主要材料是硅;
C.锌的相对原子质量比铜大,溶液质量增加;
D.氢氧燃料电池工作时氢气被氧化生成水.
解答 解:A.锌锰干电池工作一段时间后,锌失电子生成锌离子导致锌的质量逐渐减小,所以锌外壳逐渐变薄,故A正确;
B.二氧化硅不导电,硅为半导体材料,太阳能电池的主要材料是硅,故B错误;
C.锌的相对原子质量比铜大,溶液质量增加,故C错误;
D.氢氧燃料电池工作时氢气被氧化生成水,故D正确.
故选AD.
点评 本题考查了原电池原理、物质的用途等知识点,为高频考点,侧重于化学与生活、生产的考查,根据原电池概念、原电池电极上发生的反应、物质的性质等知识点分析解答,题目难度不大.

练习册系列答案
 巧学巧练系列答案
巧学巧练系列答案
相关题目
11.影响物质体积大小的因素不包括( )
| A. | 物质的粒子数目 | B. | 粒子的大小 | C. | 粒子间的距离 | D. | 粒子的运动频率 |
12.针对下表中十种元素,填写空格.
(1)最不活泼的元素是Ar.
(2)S原子结构示意图 .
.
(3)N、F、Cl中,原子半径最大的是Cl.
(4)最高价氧化物对应水化物酸性最强的是高氯酸(填名称).
(5)写出实验室制氯气的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
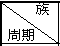 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅦA | ⅧA | O |
2 | N | O | F | |||||
3 | Na | Mg | Al | S | Cl | Ar | ||
4 | K |
(2)S原子结构示意图
 .
.(3)N、F、Cl中,原子半径最大的是Cl.
(4)最高价氧化物对应水化物酸性最强的是高氯酸(填名称).
(5)写出实验室制氯气的离子方程式MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
9.某羧酸脂的分子式为为C16H14O4,1mol该酯完全水解可得到2mol羧酸和1mol乙二醇(HOCH2-CH2OH),该羧酸的分子式为( )
| A. | C7H6O2 | B. | C8H8O4 | C. | C14H12O2 | D. | C6H6O4 |
12.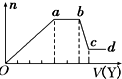 某无色稀溶液X中,可能含有如表所列离子中的某几种.
某无色稀溶液X中,可能含有如表所列离子中的某几种.
取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(V)的关系如图所示下列说法正确的是( )
 某无色稀溶液X中,可能含有如表所列离子中的某几种.
某无色稀溶液X中,可能含有如表所列离子中的某几种.| 阴离子 | CO32-、SiO32-、AlO2-、Cl- |
| 阳离子 | Al3+、Fe3+、Mg2+、NH4+、Na+ |
| A. | 若Y是盐酸,则X中一定含有CO32-、SiO32-、AlO2-和Na+ | |
| B. | 若Y是NaOH溶液,则X中一定含有Al3+、Fe3+、NH4+、Cl- | |
| C. | 若Y是NaOH溶液,则ab段发生反应的离子方程式为:NH4++OH-═NH3↑+H2O | |
| D. | 若Y是NaOH溶液,则X中的Al3+、Mg2+、NH4+ 物质的量之比为1:1:2 |
13.选取两个完全相同的密闭容器A、B,向A、B中都加入SO2和O2各l g,发生反应2SO2(g)+O2(g)?2SO3(g);△H<0.反应过程中A保持恒温、恒容,B保持恒温、恒压,并都达到平衡状态.下列说法中,正确的是( )
| A. | 平衡时SO2的转化率:A>B | |
| B. | 可逆反应从开始到平衡放出的热量:A<B | |
| C. | 平衡时混合气体的总物质的量:A<B | |
| D. | 平衡时的化学反应速率:A>B |
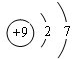 ,Z单质与H2O反应的化学方程式为2H2O+2F2=4HF+O2,在该反应中,氧化剂与还原剂的物质的量之比为1:1.
,Z单质与H2O反应的化学方程式为2H2O+2F2=4HF+O2,在该反应中,氧化剂与还原剂的物质的量之比为1:1.