题目内容
14.草酸(H2C2O4)广泛存在于食品中,人们对其及相关产品进行了深入研究.己知反应:H2C2O4(l)═H2O(g)+CO(g)+CO2(g)△H=+340J•mol-1,为了使草酸分解,通过CO燃烧反应提供能量:2CO(g)+O2(g)=2CO2(g)△H=-566kJ•mol-1,空气中氧气的体积分数为0.20,则分解的草酸与所需空气的物质的量之比为$\frac{1}{3}$.分析 设分解的草酸的物质的量为xmol,需氧气的物质的量为ymol,由:H2C2O4(l)═H2O(g)+CO(g)+CO2(g)△H=+340J•mol-1,则1mol草酸放出热量为:340J,所以xmol草酸分解吸收的量为340x,0.20ymol的氧气与一氧化碳放出的热量为0.2y×566kJ=113.2ykJ,由题意可知340x=113.2ykJ,由此分析解答.
解答 解:设分解的草酸的物质的量为xmol,需氧气的物质的量为ymol,由:H2C2O4(l)═H2O(g)+CO(g)+CO2(g)△H=+340J•mol-1,则1mol草酸放出热量为:340J,所以xmol草酸分解吸收的量为340x,0.20ymol的氧气与一氧化碳放出的热量为0.2y×566kJ=113.2ykJ,由题意可知340x=113.2ykJ,所以$\frac{x}{y}$=$\frac{1}{3}$,故答案为:$\frac{1}{3}$.
点评 本题考查氧化还原反应中能量变化的应用,难度中等,清楚根据吸热和放热的量相等列出关系式是解题的关键.

练习册系列答案
相关题目
4.标准状况下,均含有NA个电子的H2O和CH4,具有相同的( )
| A. | 物质的量 | B. | 体积 | C. | 质量 | D. | 氢原子数 |
5.化学与材料、生活和环境密切相关.下列有关说法中错误的是( )
| A. | 食品袋中常放有硅胶和铁粉,都能起到干燥的作用 | |
| B. | 明矾净水时发生了化学及物理变化,能起到净水作用,而没有杀菌、消毒的作用 | |
| C. | 大力实施矿物燃料脱硫脱硝技术,能减少硫、氮氧化物的排放 | |
| D. | 某新型航天服材料主要成分是由碳化硅、陶瓷和碳纤维复合而成,它是一种新型无机非金属材料 |
2.五种短周期元素的部分性质数据如下:下列叙述正确的是( )
| 元素 | T | X | Y | Z | W |
| 原子半径/nm | 0.037 | 0.075 | 0.099 | 0.102 | 0.143 |
| 最高或最低化合价 | +1 | +5,-3 | +7,-1 | +6,-2 | +3 |
| A. | X的阴离子半径小于T的阳离子半径 | |
| B. | Y的氢化物的热稳定性比Z的氢化物的小 | |
| C. | Y单质与Fe反应生成的化合物中,铁元素显+3价 | |
| D. | Z元素的氧化物对应的水化物一定为强酸 |
9.某羧酸脂的分子式为为C16H14O4,1mol该酯完全水解可得到2mol羧酸和1mol乙二醇(HOCH2-CH2OH),该羧酸的分子式为( )
| A. | C7H6O2 | B. | C8H8O4 | C. | C14H12O2 | D. | C6H6O4 |
5.下列各组物质全部是弱电解质的是( )
| A. | H2SiO3 H2S CO2 | |
| B. | H2O NH3•H2O HClO HF | |
| C. | H2SO3 Ba(OH)2 BaSO4 | |
| D. | Cu(OH)2 CH3COOH C2H5OH CH3COONa |
6.下列反应中不属于氧化还原反应是( )
| A. | H2+CuO$\frac{\underline{\;\;△\;\;}}{\;}$ Cu+H2O | |
| B. | NH4Cl+NaOH═NH3•H2O+NaCl | |
| C. | Cu+2H2SO4 (浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O | |
| D. | 2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑ |
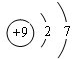 ,Z单质与H2O反应的化学方程式为2H2O+2F2=4HF+O2,在该反应中,氧化剂与还原剂的物质的量之比为1:1.
,Z单质与H2O反应的化学方程式为2H2O+2F2=4HF+O2,在该反应中,氧化剂与还原剂的物质的量之比为1:1.