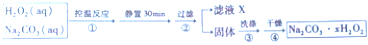
题目内容
5.常温下,在pH值为4的FeCl3溶液、pH值为10的Na2CO3溶液和pH值为2的盐酸溶液中,水的电离度分别为α1、α2和α3,则它们的关系为( )| A. | α1=α2>α3 | B. | α1<α2<α3 | C. | α1>α2>α3 | D. | 无法判断 |
分析 电离度α=$\frac{已经电离的弱电解质分子数}{溶液中弱电解质总分子数}$×100%,根据题中数据,分别求算出水电离的氢离子或者氢氧根浓度,酸碱抑制水的电离,水解的盐促进水的电离.
解答 解:由于水的电离度为:α(H2O)=$\frac{电离的水}{总的水}$×100%;
pH值为4的FeCl3溶液,溶液中的氢离子来自水的电离,c(H+)=10-4 mol/L;
pH值为10的K2CO3溶液,溶液中的氢氧根离子来自水的电离,c(OH-)=10-4 mol/L;
pH值为2的盐酸溶液,水电离出氢氧根离子浓度10-12mol/L,
由以上数据可以得出,两溶液中水的电离程度相同,即α1=α2>α3,故选A.
点评 本题考查水的电离程度大小比较,主要是影响水电离平衡的因素分析判断,题目难度中等.

练习册系列答案
 灵星计算小达人系列答案
灵星计算小达人系列答案
相关题目
2.将二氧化硫通入氯水中,所得溶液的pH比原来氯水溶液的pH( )
| A. | 大 | B. | 小 | ||
| C. | 相同 | D. | 可能变大也可能变小 |
16.煤化工中两个重要反应为①C(s)+H2O(g)?H2(g)+CO(g)
△H=+131.3kJ•mol-1,②CO(g)+H2O(g)$?_{△}^{催化剂}$CO2(g)+H2(g).
(1)下列说法正确的是A.
A.当反应①的容器中混合气体的密度不再变化时反应达到最大限度
B.反应②的熵变△S>0
C.反应①中增加C固体的量能增大反应速率
D.在反应②中及时分离出产生的H2对正反应速率无影响
(2)若工业上要增加反应①的速率,最经济的措施为粉碎煤炭、增加H2O(g)的浓度、使用合适的催化剂.
(3)现将不同量的CO(g)和H2O(g)分别通入2L恒容密闭容器中进行反应,得到如下三组数据:
①实验Ⅰ中,从反应开始到反应达到平衡时,H2O(g)的平均反应速率为0.16mol•L-1•min-1.
②CO(g)和H2O(g)反应的△H小于0(填“大于”“小于”或“等于”).
③实验Ⅲ中,若平衡时,CO的转化率大于水蒸气,则a、b必须满足的关系是a<b,与实验Ⅱ相比,化学平衡常数不变(填“增大”“减小”或“不变”).
④若在900℃时,实验Ⅱ反应达到平衡后,向此容器中再加入1mol CO、0.5mol H2O、0.2mol CO2、0.5mol H2,平衡正反应方向移动(填“向正反应方向移动”“向逆反应方向移动”“不移动”).
(4)CO、H2可用于生产甲醇和甲醚,其反应为(m、n均大于0):
反应①:CO(g)+2H2(g)?CH3OH(g)△H=-mkJ•mol-1
反应②:2CO(g)+4H2(g)?CH3OCH3(g)+H2O(g)△H=-nkJ•mol-1
反应③:2CH3OH(g)?CH3OCH3(g)+H2O(g)△H<0
则m与n的关系为n>2m.
△H=+131.3kJ•mol-1,②CO(g)+H2O(g)$?_{△}^{催化剂}$CO2(g)+H2(g).
(1)下列说法正确的是A.
A.当反应①的容器中混合气体的密度不再变化时反应达到最大限度
B.反应②的熵变△S>0
C.反应①中增加C固体的量能增大反应速率
D.在反应②中及时分离出产生的H2对正反应速率无影响
(2)若工业上要增加反应①的速率,最经济的措施为粉碎煤炭、增加H2O(g)的浓度、使用合适的催化剂.
(3)现将不同量的CO(g)和H2O(g)分别通入2L恒容密闭容器中进行反应,得到如下三组数据:
| 实验 组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| CO | H2O | H2 | CO2 | |||
| Ⅰ | 650 | 4 | 2 | 1.6 | 1.6 | 5 |
| Ⅱ | 900 | 2 | 1 | 0.5 | 0.5 | 3 |
| Ⅲ | 900 | a | b | c | d | t |
②CO(g)和H2O(g)反应的△H小于0(填“大于”“小于”或“等于”).
③实验Ⅲ中,若平衡时,CO的转化率大于水蒸气,则a、b必须满足的关系是a<b,与实验Ⅱ相比,化学平衡常数不变(填“增大”“减小”或“不变”).
④若在900℃时,实验Ⅱ反应达到平衡后,向此容器中再加入1mol CO、0.5mol H2O、0.2mol CO2、0.5mol H2,平衡正反应方向移动(填“向正反应方向移动”“向逆反应方向移动”“不移动”).
(4)CO、H2可用于生产甲醇和甲醚,其反应为(m、n均大于0):
反应①:CO(g)+2H2(g)?CH3OH(g)△H=-mkJ•mol-1
反应②:2CO(g)+4H2(g)?CH3OCH3(g)+H2O(g)△H=-nkJ•mol-1
反应③:2CH3OH(g)?CH3OCH3(g)+H2O(g)△H<0
则m与n的关系为n>2m.
13.用NA表示阿伏加德罗常数,下列说法中正确的是( )
| A. | 标准状况下,1 mol SO3的体积约为22.4L | |
| B. | 1 mol钠原子中含有的电子数为NA | |
| C. | 常温常压下,17g NH3含氢原子数目为3NA | |
| D. | 1molFe与足量的氯气反应时,转移的电子数是2NA |
10.乙醇分子结构式如图所示,下列反应及断键部位正确的是( )
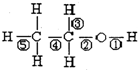

| A. | 乙醇与钠的反应是⑤键断裂 | B. | 乙醇的催化氧化反应是②③键断裂 | ||
| C. | 乙醇与乙酸发生的反应是②键断裂 | D. | 乙醇完全燃烧是①②③④⑤键断裂 |
17.下列说法不正确的是( )
| A. | Na2O2可用于呼吸面具中氧气的来源 | |
| B. | NaHCO3的热稳定性大于Na2CO3 | |
| C. | 乙醇可与金属钠反应放出氢气 | |
| D. | 金属钠着火时,可用细沙覆盖灭火 |
14.某物质可在酸性条件下水解并且生成两种相对分子质量相等的物质,该物质是( )
| A. | HCOOC2H5 | B. | CH3COOC2H5 | C. | C6H12O6 | D. | (C6H10O5)n |
15.下列物质的反应过程符合如图所示过程的是( )


| A. | 向CaCl2溶液中通入过量CO2 | B. | 向水玻璃溶液中通入过量CO2 | ||
| C. | 向澄清石灰水中通入过量CO2 | D. | 向水玻璃溶液中加入过量盐酸 |