题目内容
15.下列物质的反应过程符合如图所示过程的是( )
| A. | 向CaCl2溶液中通入过量CO2 | B. | 向水玻璃溶液中通入过量CO2 | ||
| C. | 向澄清石灰水中通入过量CO2 | D. | 向水玻璃溶液中加入过量盐酸 |
分析 由图可知,通入气体,先生成沉淀,后沉淀溶解,且消耗的气体相同,以此来解答,
A..向CaCl2溶液中通入CO2气体,根本不发生反应;
B.向Na2SiO3溶液中通入CO2气体,生成硅酸沉淀,硅酸和过量二氧化碳不反应;
C.氢氧化钙和二氧化碳反应生成碳酸钙和水,过量二氧化碳和碳酸钙反应生成碳酸氢钙,两个过程中消耗二氧化碳相同;
D.水玻璃中加入过量盐酸只能生成硅酸沉淀,沉淀不溶于盐酸.
解答 解:A.由于碳酸酸性比盐酸弱,向CaCl2溶液中通入CO2气体,根本不发生反应,故A错误;
B.向Na2SiO3溶液中通入CO2气体,生成硅酸沉淀,气体过量沉淀不溶解,与图象不符,故B错误;
C.向澄清石灰水中通入CO2气体,反应生成碳酸钙沉淀,CO2+Ca(OH)2=CaCO3↓+H2O,气体过量沉淀溶解,CaCO3+CO2+H2O=Ca(HCO3)2,且两个反应中消耗气体相同,故C正确;
D.向水玻璃溶液中加入过量盐酸,生成硅酸沉淀,盐酸过量沉淀不溶解,与图象不符,故D错误;
故选C.
点评 本题以图象形式考查物质之间的反应,为高频考点,把握物质之间的复分解反应为解答的关键,注意图象中沉淀生成和沉淀溶解消耗的气体体积关系为解答的易错点,题目难度中等.

练习册系列答案
相关题目
5.常温下,在pH值为4的FeCl3溶液、pH值为10的Na2CO3溶液和pH值为2的盐酸溶液中,水的电离度分别为α1、α2和α3,则它们的关系为( )
| A. | α1=α2>α3 | B. | α1<α2<α3 | C. | α1>α2>α3 | D. | 无法判断 |
6.下列属于放热反应的是( )
| A. | 2Na+2H2O═2NaOH+H2↑ | |
| B. | CaCO3 $\frac{\underline{\;高温\;}}{\;}$ CaO+CO2↑ | |
| C. | C+H2O $\frac{\underline{\;高温\;}}{\;}$ CO+H2 | |
| D. | 2NH4Cl+Ba(OH)2•8H2O═BaCl2+2NH3↑+10H2O |
3.短周期元素A、B、C、D的原子序数依次递增,它们的核电荷数之和为32,原子最外层电子数之和为10,A与C同主族,B与D同主族,A、C原子的最外层电子数之和等于B原子的次外层电子数,下列有关叙述正确的是( )
| A. | B、D的最高价氧化物中,B、D与氧原子都形成离子键 | |
| B. | 四种元素的原子半径:A<B<C<D | |
| C. | D元素位于元素周期表中的第三周期第ⅣA族 | |
| D. | 一定条件下,B单质能置换出D单质,C单质能置换出A单质 |
10.下列叙述正确的是( )
| A. | 同周期元素的原子半径以ⅤⅡA族的为最大 | |
| B. | 同主族元素两种元素原子的核外电子数的差值可能为26 | |
| C. | 短周期元素中次外层电子数是最外层电子数2倍的原子一定是非金属元素 | |
| D. | 同周期第ⅡA族和ⅢA族元素的原子序数之差不可能为25 |
20.如图有关实验原理、操作或现象不正确的是( )
| A. |  可制得金属锰,用同样的装置可制得金属铬 | |
| B. |  制取少量氨气 | |
| C. |  除去Cl2中的少量HCl | |
| D. |  制乙酸乙酯 |
15.下列说法正确的是( )
| A. | 根据反应Cu+H2SO4$\frac{\underline{\;电解\;}}{\;}$CuSO4+H2↑可推出Cu的还原性比H2的强 | |
| B. | 在反应CaH2+2H2O═Ca(OH)2+2H2↑中,水作氧化剂 | |
| C. | 反应3NO2+H2O═2HNO3+NO中氧化剂和还原剂的物质的量之比是3:1 | |
| D. | 因Cl2的氧化性强于I2的氧化性,所以置换反应I2+2NaClO3═2NaIO3+Cl2不能发生 |
16.某羧酸酯的分子式为C18H26O5,1mol该酯完全水解可得到1mol醇和2mol乙酸,该醇的分子式为( )
| A. | C14H18O5 | B. | C14H16O4 | C. | C14H22O3 | D. | C14H10O3 |
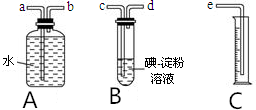 某化学兴趣小组选用如图实验装置,测定某工业尾气(含SO2、N2、O2)中SO2的含量.
某化学兴趣小组选用如图实验装置,测定某工业尾气(含SO2、N2、O2)中SO2的含量.