题目内容
10.乙醇分子结构式如图所示,下列反应及断键部位正确的是( )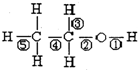
| A. | 乙醇与钠的反应是⑤键断裂 | B. | 乙醇的催化氧化反应是②③键断裂 | ||
| C. | 乙醇与乙酸发生的反应是②键断裂 | D. | 乙醇完全燃烧是①②③④⑤键断裂 |
分析 乙醇含-OH,可发生取代、消去、氧化反应,结合官能团的变化分析化学键的断裂,以此来解答.
解答 解:A.乙醇与钠的反应,生成乙醇钠和氢气,则O-H键断裂,即①键断裂,故A正确;
B.乙醇的催化氧化反应,-OH转化为-CHO,即①③键断裂,故B错误;
C.乙醇与乙酸发生酯化反应,醇脱H,则O-H键断裂,即①键断裂,故C错误;
D.乙醇的燃烧氧化反应,生成二氧化碳和水,则所有化学键都断裂,故D正确.
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握有机物的官能团与性质的关系为解答的关键,侧重醇性质的考查,题目难度不大.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
7.甲醇和正丙醇是两种常见的液态有机物,它们的某些物理性质如下表所示.据此,请判断将甲醇和正丙醇的混合物进行分离的最佳方法是( )
| 物质 | 熔点 | 沸点 | 密度 | 溶解性 |
| 甲醇 | -97.8℃ | 64.8℃ | 0.791g•mL-1 | 易溶于水、乙醇、正丙醇 |
| 正丙醇 | -126.5℃ | 97.4℃ | 0.804g•mL-1 | 能跟水、甲醇、乙醇以任意比互溶 |
| A. | 萃取 | B. | 过滤 | C. | 蒸发 | D. | 蒸馏 |
1.设NA代表阿伏伽德罗常数,下列说法正确的是( )
①22.4L氦气含有的核外电子总数为2NA
②17g羟基所含的中子数为8NA
③56g的铁发生氧化还原反应,一定失去3NA个电子
④100mL0.5mol/L的甲酸溶液中,甲酸的分子数目小于0.05NA
⑤标准状况下,22.4LCH3OH中含有的氢原子数为4NA
⑥常温常压,22.4LNO气体的分子数小于NA.
①22.4L氦气含有的核外电子总数为2NA
②17g羟基所含的中子数为8NA
③56g的铁发生氧化还原反应,一定失去3NA个电子
④100mL0.5mol/L的甲酸溶液中,甲酸的分子数目小于0.05NA
⑤标准状况下,22.4LCH3OH中含有的氢原子数为4NA
⑥常温常压,22.4LNO气体的分子数小于NA.
| A. | ①②⑤ | B. | ③④⑤ | C. | ②④⑥ | D. | ③⑤⑥ |
18.下列关于化学反应速率的叙述不正确的是( )
| A. | 食物放在冰箱中会减慢变质的速率 | |
| B. | 实验室制备CO2时,可通过增加石灰石的用量来加快反应速率 | |
| C. | 工业合成中使用适当的催化剂为了加快反应速率 | |
| D. | 实验室用锌和稀硫酸制取H2时,常滴加少量硫酸铜溶液加快反应的速率 |
5.常温下,在pH值为4的FeCl3溶液、pH值为10的Na2CO3溶液和pH值为2的盐酸溶液中,水的电离度分别为α1、α2和α3,则它们的关系为( )
| A. | α1=α2>α3 | B. | α1<α2<α3 | C. | α1>α2>α3 | D. | 无法判断 |
2.下列各组化合物中,化学键的类型相同的是( )
| A. | CO2和NaCl | B. | Na2O和Na2O2 | C. | CaCl2和Na2S | D. | HCl和NaOH |
19.下列关于常见有机化合物的说法中正确的是( )
| A. | 乙烷和Cl2在光照条件下反应生成6种氯代产物 | |
| B. | 乙醇、乙酸、乙酸乙酯都能发生取代反应,乙酸乙酯中的少量乙酸可用饱和Na2CO3溶液除去 | |
| C. | 乙烯和聚乙烯都能使溴的四氯化碳溶液褪色 | |
| D. | 糖类、油脂和蛋白质都是人体必需的营养物质,它们的组成元素相同 |
20.如图有关实验原理、操作或现象不正确的是( )
| A. |  可制得金属锰,用同样的装置可制得金属铬 | |
| B. |  制取少量氨气 | |
| C. |  除去Cl2中的少量HCl | |
| D. |  制乙酸乙酯 |
 某化学兴趣小组同学看到一则报道:某造纸厂误将槽车中漂白液(NaCl和NaClO的混合液)倒入盛放饱和KAl(SO4)2溶液的池中,造成中毒事件.该小组同学为探究中毒原因进行了如下实验.
某化学兴趣小组同学看到一则报道:某造纸厂误将槽车中漂白液(NaCl和NaClO的混合液)倒入盛放饱和KAl(SO4)2溶液的池中,造成中毒事件.该小组同学为探究中毒原因进行了如下实验.