题目内容
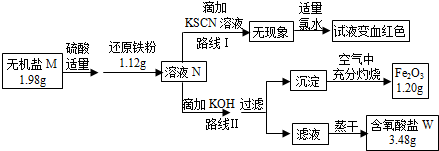
16.铝、铁的混合物溶于足量的盐酸中,再加入过量的NaOH溶液,在空气中静置,当红褐色沉淀不再增加,将沉淀滤出并充分灼烧,得到的固体残留物恰好跟原混合物的质量相等,则此合金中铝的质量分数为( )| A. | 22.2% | B. | 30.0% | C. | 75.7% | D. | 80.6% |
分析 将铁铝合金粉末溶于足量盐酸中,加入过量NaOH溶液,在空气中静置,当红褐色沉淀不再增加,则得到的沉淀为氢氧化铁,然后将沉淀滤出并充分灼烧,得到固体残留物为氧化铁,利用组成可知氧化铁中氧元素的质量等于合金中铝的质量,以此来解答.
解答 解:由铁铝合金粉末溶于足量盐酸中,加入过量NaOH溶液,在空气中静置,当红褐色沉淀不再增加,则得到的沉淀为氢氧化铁,然后将沉淀滤出并充分灼烧,得到固体残留物为氧化铁,
得到的固体残留物恰好跟原混合物的质量相等,则m(Fe、Al)=m(Fe2O3),所以合金中铝的质量等于氧化铁中氧元素的质量,合金中Al的质量分数等于氧化铁中O的质量分数,
所以原合金中铝的质量分数为:$\frac{16×3}{56×2+16×3}$×100%=30%,
故选B.
点评 本题考查混合物反应的计算,题目难度中等,明确发生的反应找出合金与氧化物的关系是解答本题的关键,注意掌握守恒思想在化学计算中的应用方法.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
4.下面对SO2和CO2的描述正确的是( )
| A. | SO2为原子晶体,CO2为分子晶体 | |
| B. | 中心原子采取的杂化方式:SO2为sp2杂化,CO2为sp杂化 | |
| C. | 都是直线形结构 | |
| D. | S原子和C原子上都没有孤电子对 |
11.下列反应中,既属于氧化还原反应又属于置换反应的是( )
| A. | CuO+H2$\frac{\underline{\;高温\;}}{\;}$Cu+H2O | B. | CO2+Ca(OH)2$\frac{\underline{\;点燃\;}}{\;}$CaCO3↓+H2O | ||
| C. | Fe2O3+3CO═2Fe+3CO2 | D. | 2Na+Cl2═2NaCl |
1.下列说法正确的是( )
| A. | 由于碳燃烧可能生成CO和CO2,所以碳的燃烧热大小与生成产物有关 | |
| B. | 101kPa时,2gH2完全燃烧生成液态水时放热285.8kJ,表示氢气燃烧热的热化学方程式为:2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol | |
| C. | 已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.3 kJ/mol,则含40.0 g NaOH的稀溶液与足量浓硫酸反应放热57.3 kJ | |
| D. | 已知C(石墨,s)=C(金刚石,s)△H>0,则石墨比金刚石稳定 |
8.已知还原性:SO2>I->Fe2+,下列离子反应不能发生的是( )
| A. | SO2+2Fe3++2H2O═SO42-+2Fe2++4H+ | |
| B. | I2+2Fe2+═2I-+2Fe3+ | |
| C. | SO2+I2+2H2O═2I-+4H++SO42- | |
| D. | 少量Cl2通入FeI2溶液中:Cl2+2I-═2Cl-+I2 |
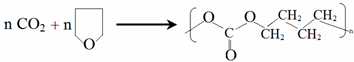
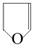
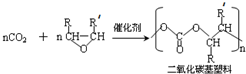 (-R、-R′代表烃基或氢原子)
(-R、-R′代表烃基或氢原子)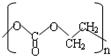 的单体是CO2和
的单体是CO2和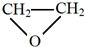 .
.
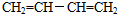 ,名称是1,3-丁二烯.
,名称是1,3-丁二烯.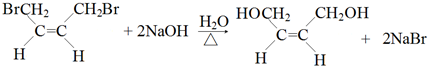 .
. .
. .
.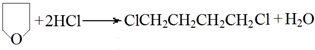 .
.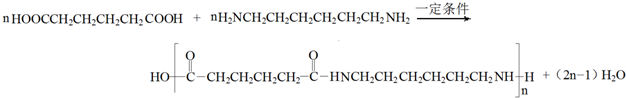 .
.
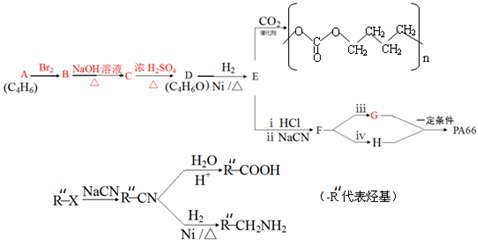
 2015年8月12日天津港特大爆炸事故,再一次引发了人们对环境问题的关注.据查危化仓库中存有大量的钠、钾、白磷(P4)、硝酸铵和氰化钠(NaCN).
2015年8月12日天津港特大爆炸事故,再一次引发了人们对环境问题的关注.据查危化仓库中存有大量的钠、钾、白磷(P4)、硝酸铵和氰化钠(NaCN). 1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂.在实验中可以用图9所示装置制备1,2-二溴乙烷.其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有浓溴(表面覆盖少量水).请填写下列空白:
1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂.在实验中可以用图9所示装置制备1,2-二溴乙烷.其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有浓溴(表面覆盖少量水).请填写下列空白: