题目内容
6.用CO2 和环氧化物共聚合成全降解二氧化碳基塑料,既可有效解决CO2过量排放引起的温室效应、又可除去白色污染.
已知该反应为:
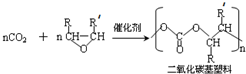 (-R、-R′代表烃基或氢原子)
(-R、-R′代表烃基或氢原子)(1)该反应为加聚反应.
(2)
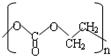 的单体是CO2和
的单体是CO2和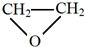 .
.通过下列途径既可以得到全降解二氧化碳基塑料还可得到用途广泛的高分子化合物PA66.
已知:
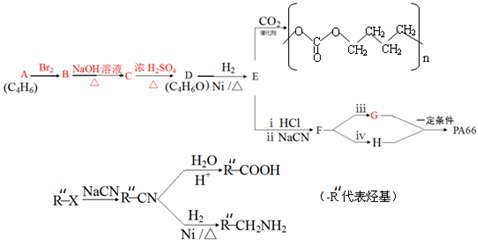
(3)A、B、C分子均为直链结构,且A、B的核磁共振氢谱都只有两个峰,峰面积之比
为1:2,则
①A的结构简式是
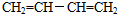 ,名称是1,3-丁二烯.
,名称是1,3-丁二烯.②B是顺式结构,B→C的化学方程式是
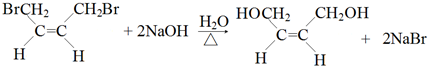 .
.③由E制备二氧化碳基塑料的化学方程式是
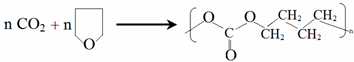 .
.(4)D的一种同分异构体在相同条件下也能制得E,其结构简式是
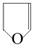 .
.(5)已知1molG可与NaHCO3溶液反应产生44.8LCO2(标准状态下),则
①1mol E与2mol HCl反应的化学方程式是
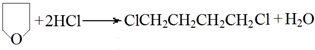 .
.②G和H在一定条件下生成PA66的化学方程式是
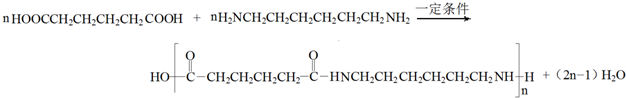 .
.
分析 (1)比较该反应的反应物和生成物结构简式可知,该反应为二氧化碳中的一个碳氧双键与另一反应物发生加聚反应,据此答题;
(2) 为加聚反应的产物,根据加聚反应的原理可知其单体;
为加聚反应的产物,根据加聚反应的原理可知其单体;
(3)(4)(5)A、B、C分子均为直链结构,且A、B的核磁共振氢谱都只有两个峰,峰面积之比为1:2,结合A的分子式可知,A为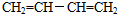 ,根据E与二氧化碳发生加聚反应的产物结构可知E为环氧丁烷,根据转化关系可知,B是顺式结构,A与溴发生1,4-加成得B为
,根据E与二氧化碳发生加聚反应的产物结构可知E为环氧丁烷,根据转化关系可知,B是顺式结构,A与溴发生1,4-加成得B为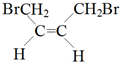 ,B发生水解得C为
,B发生水解得C为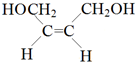 ,C在浓硫酸作用下生成D为
,C在浓硫酸作用下生成D为 ,D与氢气加成得E,1molG可与NaHCO3溶液反应产生44.8LCO2(标准状态下),说明G中有两个羧基,所以1mol环氧丁烷 与2mol HCl反应再与NaCN反应生成F为NCCH2CH2CH2CH2CN,F酸性水解得G为HOOCH2CH2CH2CH2COOH,F与氢气发生加成反应得H为H2NCH2CH2CH2CH2CH2CH2NH2,G和H发生缩聚反应得PA66为
,D与氢气加成得E,1molG可与NaHCO3溶液反应产生44.8LCO2(标准状态下),说明G中有两个羧基,所以1mol环氧丁烷 与2mol HCl反应再与NaCN反应生成F为NCCH2CH2CH2CH2CN,F酸性水解得G为HOOCH2CH2CH2CH2COOH,F与氢气发生加成反应得H为H2NCH2CH2CH2CH2CH2CH2NH2,G和H发生缩聚反应得PA66为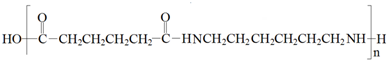 ,据此答题;
,据此答题;
解答 解:(1)比较该反应的反应物和生成物结构简式可知,该反应为二氧化碳中的一个碳氧双键与另一反应物发生加聚反应,
故答案为:加聚;
(2) 为加聚反应的产物,根据加聚反应的原理可知其单体为CO2和
为加聚反应的产物,根据加聚反应的原理可知其单体为CO2和 ,
,
故答案为:CO2和 ;
;
A、B、C分子均为直链结构,且A、B的核磁共振氢谱都只有两个峰,峰面积之比为1:2,结合A的分子式可知,A为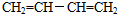 ,根据E与二氧化碳发生加聚反应的产物结构可知E为环氧丁烷,根据转化关系可知,B是顺式结构,A与溴发生1,4-加成得B为
,根据E与二氧化碳发生加聚反应的产物结构可知E为环氧丁烷,根据转化关系可知,B是顺式结构,A与溴发生1,4-加成得B为 ,B发生水解得C为
,B发生水解得C为 ,C在浓硫酸作用下生成D为
,C在浓硫酸作用下生成D为 ,D与氢气加成得E,1molG可与NaHCO3溶液反应产生44.8LCO2(标准状态下),说明G中有两个羧基,所以1mol环氧丁烷 与2mol HCl反应再与NaCN反应生成F为NCCH2CH2CH2CH2CN,F酸性水解得G为HOOCH2CH2CH2CH2COOH,F与氢气发生加成反应得H为H2NCH2CH2CH2CH2CH2CH2NH2,G和H发生缩聚反应得PA66为
,D与氢气加成得E,1molG可与NaHCO3溶液反应产生44.8LCO2(标准状态下),说明G中有两个羧基,所以1mol环氧丁烷 与2mol HCl反应再与NaCN反应生成F为NCCH2CH2CH2CH2CN,F酸性水解得G为HOOCH2CH2CH2CH2COOH,F与氢气发生加成反应得H为H2NCH2CH2CH2CH2CH2CH2NH2,G和H发生缩聚反应得PA66为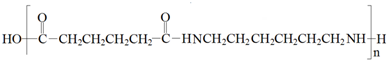 ,
,
(3)①根据上面的分析可知,A为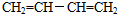 ,其名称为1,3-丁二烯,
,其名称为1,3-丁二烯,
故答案为: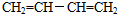 ;1,3-丁二烯;
;1,3-丁二烯;
②B为 ,B→C的化学方程式是
,B→C的化学方程式是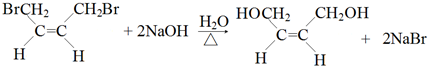 ,
,
故答案为: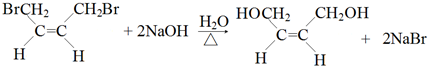 ;
;
③E为环氧丁烷,由E制备二氧化碳基塑料的化学方程式是 ,
,
故答案为: ;
;
(4)D为 ,D的一种同分异构体在相同条件下也能制得E,其结构简式是
,D的一种同分异构体在相同条件下也能制得E,其结构简式是  ,
,
故答案为: ;
;
(5)①1mol E与2mol HCl反应的化学方程式是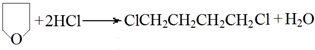 ,②G和H在一定条件下生成PA66的化学方程式是
,②G和H在一定条件下生成PA66的化学方程式是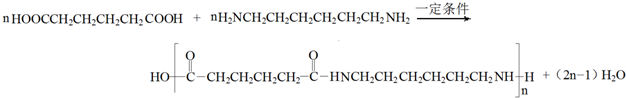 ,
,
故答案为: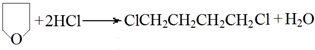 ;
;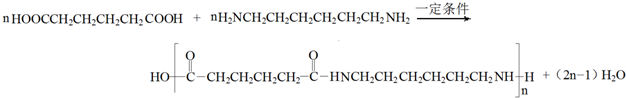 .
.
点评 本题考查有机物推断,需要学生对给予的信息进行利用,能较好的考查学生自学能力,注意根据A的分子式与E的结构进行推断,注意掌握官能团的性质与转化,题目难度中等.

| A. | 液氨汽化时要吸收大量的热,可用作制冷剂 | |
| B. | SiO2既能与HF反应,又能与NaOH反应,属于两性氧化物 | |
| C. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| D. | 氯化铝是一种电解质,可用于电解制铝 |
| A. | S的燃烧热为 297.2 kJ/mol | |
| B. | S(g)+O2(g)=SO2(g)放出的热量大于297.2 kJ | |
| C. | S(g)+O2(g)=SO2(g)放出的热量小于297.2 kJ | |
| D. | 形成1 mol SO 2中的化学键所释放的总能量大于断裂1 mol S(s)和1 mol O2(g)中的化学键所吸收的总能量 |
| A. | 加入足量氢氧化钠溶液后产生的浑浊不溶解 | |
| B. | 用pH试纸检验呈弱酸性 | |
| C. | 滴入KSCN溶液后溶液变血红色 | |
| D. | 溶液显浅黄色 |
| 离子 | Fe3+ | Cu2+ | SO42- | Na+ | H+ |
| 浓度/(mol/L) | 2×10-3 | 1×10-3 | 1×10-2 | 2×10-3 |
(2)为了减少污染并变废为宝,工程师们设计了如下流程,回收铜和绿矾(FeSO4•7H2O).
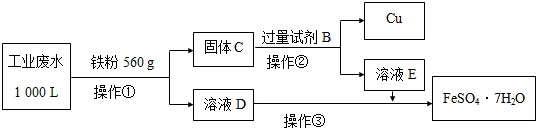
①工业废水中加入铁粉后,反应的离子方程式为:Fe+Cu2+═Fe2++Cu、Fe+2Fe3+═3Fe2+、Fe+2H+═Fe2++H2↑.
②试剂B是H2SO4.
③操作③是蒸发浓缩、冷却结晶、过滤,最后用少量冷水洗涤晶体,在低温下干燥.
④通过检验溶液D中Fe3+来判断废水中Fe3+是否除尽,实验方法是取少量D中溶液于试管中,滴加1滴KSCN溶液,不出现红色,说明废水中Fe3+除尽.
⑤获得的FeSO4•7H2O需密闭保存,原因是FeSO4有还原性,易被氧化(或FeSO4•7H2O失去结晶水).
⑥上述1000L废水经处理,可获得 FeSO4•7H2O的物质的量是12mol.
| A. | 22.2% | B. | 30.0% | C. | 75.7% | D. | 80.6% |
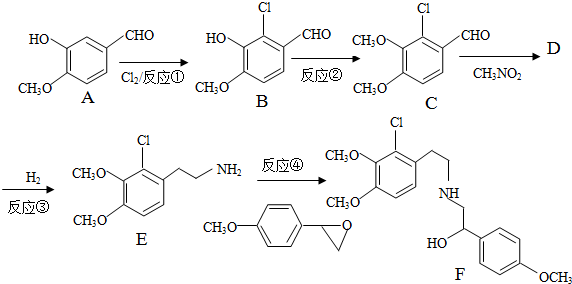
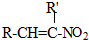 +H2O
+H2O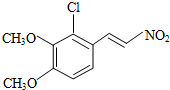 ,反应③中1摩尔D需要4摩尔H2才能转化为E
,反应③中1摩尔D需要4摩尔H2才能转化为E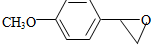 很多种同分异构体,请写出符合下列条件的一种同分异构体的结构简式
很多种同分异构体,请写出符合下列条件的一种同分异构体的结构简式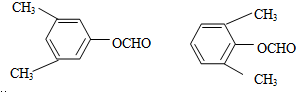 .
.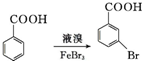 .写出以
.写出以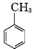 为原料制备
为原料制备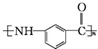 的合成路线流程图(无机试剂任选).(合成路线常用表示方法为:A$→_{反应试剂}^{反应试剂}$B …$→_{反应试剂}^{反应试剂}$目标产物)
的合成路线流程图(无机试剂任选).(合成路线常用表示方法为:A$→_{反应试剂}^{反应试剂}$B …$→_{反应试剂}^{反应试剂}$目标产物)