题目内容
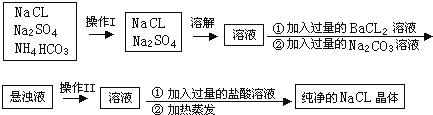
已知某工业废水中含有大量CuSO4,少量的Ag+、Hg2+以及部分污水,通过下述过程可从该废水中检验SO
并回收硫酸铜晶体及其他物质.
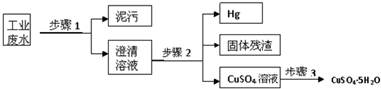
(1)对废水中含有的SO42-进行检验的操作是 .
(2)步骤1的主要操作是 ,
(3)步骤2中需加入某种试剂后再将混合物分离,该试剂是(填化学式) ,固体残渣的成分是(填化学式) ,步骤2得到Hg的方程式为
(溶液中的阴离子为SO42-).此步骤应该在通风橱中进行,原因是 .
(4)步骤3中涉及的操作是:蒸发浓缩、 、过滤、烘干.
2- 4 |

(1)对废水中含有的SO42-进行检验的操作是
(2)步骤1的主要操作是
(3)步骤2中需加入某种试剂后再将混合物分离,该试剂是(填化学式)
(溶液中的阴离子为SO42-).此步骤应该在通风橱中进行,原因是
(4)步骤3中涉及的操作是:蒸发浓缩、
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:工业废水中含有大量CuSO4,少量的Ag+、Hg2+以及部分污泥,步骤1过滤,得到溶液中含有Cu2+、Ag+、Hg2+、SO42-,再加入Cu还原Ag+、Hg2+,过滤得到固体为Ag、Cu,和硫酸铜溶液,把溶液蒸发浓缩、冷却结晶、过滤、烘干,得到硫酸铜晶体;
(1)SO42-的检验方法:加HCl和氯化钡溶液;
(2)分离固体和液体用过滤;
(3)根据流程可知步骤2加入的是金属单质,来还原Ag+、Hg2+;根据发生的反应判断固体残渣的成分;HgSO4与Cu发生置换反应;
(4)根据从溶液中提取溶质晶体的方法分析.
(1)SO42-的检验方法:加HCl和氯化钡溶液;
(2)分离固体和液体用过滤;
(3)根据流程可知步骤2加入的是金属单质,来还原Ag+、Hg2+;根据发生的反应判断固体残渣的成分;HgSO4与Cu发生置换反应;
(4)根据从溶液中提取溶质晶体的方法分析.
解答:
解:工业废水中含有大量CuSO4,少量的Ag+、Hg2+以及部分污泥,步骤1过滤,得到溶液中含有Cu2+、Ag+、Hg2+、SO42-,再加入Cu还原Ag+、Hg2+,过滤得到固体为Ag、Cu,和硫酸铜溶液,把溶液蒸发浓缩、冷却结晶、过滤、烘干,得到硫酸铜晶体;
(1)SO42-的检验方法:加HCl和氯化钡溶液,具体的实验操作为:取少量废水于试管中,加足量稀盐酸,静置,在上层清液中滴加BaCl2溶液,若有白色沉淀,说明含有SO42-;
故答案为:取少量废水于试管中,加足量稀盐酸,静置,在上层清液中滴加BaCl2溶液,若有白色沉淀,说明含有SO42-;
(2)步骤1的主要操作是分离固体和液体用过滤,故答案为:过滤;
(3)根据流程可知步骤2加入过量的Cu还原Ag+、Hg2+得到Ag、Hg和过量的Cu,过滤得到固体为Ag、Cu,HgSO4与Cu发生置换反应,其化学方程式为:HgSO4+Cu=Hg+CuSO4;Hg具有挥发性,有毒,所以应该在通风橱中进行,
故答案为:Cu;Ag、Cu;HgSO4+Cu=Hg+CuSO4;Hg具有挥发性,有毒;
(4)步骤3是从溶液中提取溶质晶体,涉及的操作是:蒸发浓缩、冷却结晶、过滤、烘干,故答案为:冷却结晶.
(1)SO42-的检验方法:加HCl和氯化钡溶液,具体的实验操作为:取少量废水于试管中,加足量稀盐酸,静置,在上层清液中滴加BaCl2溶液,若有白色沉淀,说明含有SO42-;
故答案为:取少量废水于试管中,加足量稀盐酸,静置,在上层清液中滴加BaCl2溶液,若有白色沉淀,说明含有SO42-;
(2)步骤1的主要操作是分离固体和液体用过滤,故答案为:过滤;
(3)根据流程可知步骤2加入过量的Cu还原Ag+、Hg2+得到Ag、Hg和过量的Cu,过滤得到固体为Ag、Cu,HgSO4与Cu发生置换反应,其化学方程式为:HgSO4+Cu=Hg+CuSO4;Hg具有挥发性,有毒,所以应该在通风橱中进行,
故答案为:Cu;Ag、Cu;HgSO4+Cu=Hg+CuSO4;Hg具有挥发性,有毒;
(4)步骤3是从溶液中提取溶质晶体,涉及的操作是:蒸发浓缩、冷却结晶、过滤、烘干,故答案为:冷却结晶.
点评:本题主要考查了从废水中回收硫酸铜晶体及其他物质,掌握反应的原理和步骤是解题的关键,题目难度中等,注意把握离子之间的反应.

练习册系列答案
 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案
相关题目
等质量的下列物质分别与盐酸反应,消耗HCl的物质的量最少的是( )
| A、Na |
| B、Na2O2 |
| C、Na2CO3 |
| D、Ca(HCO3)2 |
一定条件下的密闭容器中有如下反应:4NH3(g)+5O2(g)?4NO(g)+6H2O(g)△H=-905.9kJ?mol-1,下列叙述正确的是( )
| A、当NH3、O2、NO、H2O浓度比为4:5:4:6时达到平衡 | ||
B、平衡时v正(O2)=
| ||
| C、平衡后减小压强,混合气体平均摩尔质量增大 | ||
| D、平衡后升高温度,混合气体中NO含量降低 |