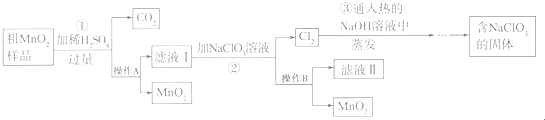
题目内容
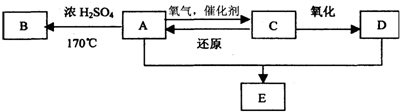
A是一种红棕色金属氧化物,B、D是金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解.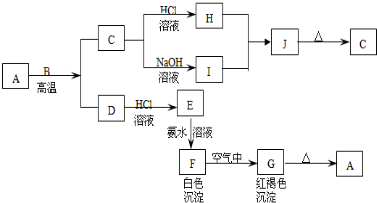
(1)写出下列物质的化学式:A: E: J: G:
(2)按要求写方程式:
A与B在高温条件下生成C和D的化学方程式: ;
C转化为I的离子方程式: .

(1)写出下列物质的化学式:A:
(2)按要求写方程式:
A与B在高温条件下生成C和D的化学方程式:
C转化为I的离子方程式:
考点:无机物的推断
专题:
分析:A是一种红棕色金属氧化物,所以是三氧化二铁,和金属B在高温下发生铝热反应,生成的C为铝的氧化物,既能和酸反应又能和碱反应,白色沉淀在空气中变成红褐色沉淀,一定是氢氧化亚铁和氢氧化铁之间的转换,所以G是氢氧化铁,F是氢氧化亚铁,根据物质的性质可推断得,E是氯化亚铁,D是金属铁,J是一种难溶于水的白色化合物为氢氧化铝,则金属B是铝,H是氯化铝,I是偏铝酸钠,根据铁及化合物以及铝及化合物的有关性质来回答;
解答:
解:A是一种红棕色金属氧化物,所以是三氧化二铁,和金属B在高温下发生铝热反应,生成的C为铝的氧化物,既能和酸反应又能和碱反应,白色沉淀在空气中变成红褐色沉淀,一定是氢氧化亚铁和氢氧化铁之间的转换,所以G是氢氧化铁,F是氢氧化亚铁,根据物质的性质可推断得,E是氯化亚铁,D是金属铁,J是一种难溶于水的白色化合物为氢氧化铝,则金属B是铝,H是氯化铝,I是偏铝酸钠,
(1)根据上面的分析可知,则A为Fe2O3,E是氯化亚铁,J是氢氧化铝,G是氢氧化铁,
故答案为:Fe2O3、FeCl2、Al(OH)3、Fe(OH)3;
(2)Fe2O3与Al在高温条件下生成Fe和Al2O3,化学方程式为Fe2O3+2Al
Al2O3+2Fe,
故答案为:Fe2O3+2Al
Al2O3+2Fe;
氧化铝是两性氧化物,能和烧碱反应生成偏铝酸钠和水,离子反应方程式为Al2O3+2OH-=2AlO2-+H2O,
故答案为:Al2O3+2OH-=2AlO2-+H2O.
(1)根据上面的分析可知,则A为Fe2O3,E是氯化亚铁,J是氢氧化铝,G是氢氧化铁,
故答案为:Fe2O3、FeCl2、Al(OH)3、Fe(OH)3;
(2)Fe2O3与Al在高温条件下生成Fe和Al2O3,化学方程式为Fe2O3+2Al
| ||
故答案为:Fe2O3+2Al
| ||
氧化铝是两性氧化物,能和烧碱反应生成偏铝酸钠和水,离子反应方程式为Al2O3+2OH-=2AlO2-+H2O,
故答案为:Al2O3+2OH-=2AlO2-+H2O.
点评:本题主要考查了元素化合物知识,解题时要注意框图推断题的突破口,根据所学的物质的性质进行回答,难度不大.

练习册系列答案
 步步高达标卷系列答案
步步高达标卷系列答案
相关题目
如表中物质的分类组合完全正确的是( )
| 编 号 | A | B | C | D |
| 强电解质 | KNO3 | H2SO4 | Ba(OH)2 | BaSO4 |
| 弱电解质 | CH3COOH | CaCO3 | H2S | NH3?H2O |
| 非电解质 | SO2 | CO2 | Cl2 | C2H5OH溶液 |
| A、A | B、B | C、C | D、D |
下列说法正确的是( )
| A、在0℃、101 kPa条件下,某气体的体积为22.4 L,则该气体的物质的量约为1 mol |
| B、1 mol某气体体积为22.4 L,则该气体所处状态一定为标准状况 |
| C、标准状况下,1 mol H2O的体积为22.4 L |
| D、1 mol CO2在25℃和101KPa时,体积约为22.4L |